
9. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,
辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
 A.2H+(aq) +
A.2H+(aq) + (aq)+
(aq)+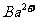 (aq)+2OH
(aq)+2OH (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H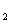 O(1);
O(1); H=
H=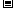 57.3 kJ/mol
57.3 kJ/mol
 B.KOH(aq)+
B.KOH(aq)+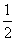 H
H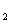 SO4(aq)=
SO4(aq)=
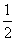 K
K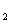 SO4(aq)+H
SO4(aq)+H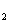 O(l);
O(l);  H=
H=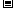 57.3kJ/mol
57.3kJ/mol
 C.C8H18(I)+
C.C8H18(I)+ 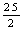 O
O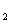 (g)=8CO
(g)=8CO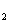 (g)+ 9H
(g)+ 9H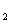 O;
O;  H=
H=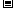 5518 kJ/mol
5518 kJ/mol
 D.2C8H18(g)+25O
D.2C8H18(g)+25O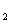 (g)=16CO
(g)=16CO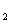 (g)+18H
(g)+18H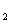 O(1);
O(1);  H=
H=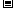 5518 kJ/mol
5518 kJ/mol
8. X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。
X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A.
 还原性:X的氧化物>Y的氧化物>Z的氢化物
还原性:X的氧化物>Y的氧化物>Z的氢化物
B.
 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.
 YX
YX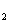 、M
、M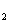 Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
D.
 Z元素的最高价氧化物的水化物的化学式为HZO4
Z元素的最高价氧化物的水化物的化学式为HZO4
6.开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是
A. 氮化硅陶瓷是新型无机非金属材料 B、C60属于原子晶体,用于制造纳米材料
C 纤维素乙酸酯属于天然高分子材料 D、单晶硅常用于制造光导纤维
7 在下列给定条件的溶液中,一定能大量共存的离子组是
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、、H+、Cl-、HSO3- B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.FeCl2溶液:K+、.Na+、.SO42-、.AlO2- D.Kw /c(H+)=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
31.(10分)将0.04 mol的KMnO4固体加热一段时间后,收集到a mol单质气体,此时KMnO4的分解率为x,在反应后残留固体中加入过量的浓盐酸并加热充分反应, 又收集到b mol的单质气体,设锰元素全部以Mn2+存在于反应后的溶液中。
(1) 当x=2\3时,在反应后残留固体中有______________种物质和浓盐酸再一定条件下反应,氧化浓盐酸得氯气做多的物质是______________
(2) 当x=________时(a+b) 取最小值,且最小值为_______。
(3) a+b=______________(用x表示)。
30.(12分)
某研究性小组借助A-D的仪器装置完成有关实验
[实验一]收集NO气体。
(1) 用装置A收集NO气体,正确的操作是 (填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
[实验二]为了探究镀锌薄铁板上的锌的质量分数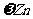 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),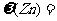 = 。
= 。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将 (填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(5)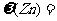 。
。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
29、(10分)某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。
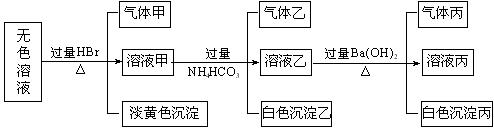
试回答下列问题:
(1)生成淡黄色沉淀的离子方程式为 ___________________________ 。
(2)由溶液甲生成沉淀乙的离子方程式 ___________________________ 。
(3)沉淀丙是 _____________________________ 。
(4)气体甲的成分有几种可能 ______。
(5)综合上述信息,可以肯定存在的离子有 _______________ 
28.(6分)高温下,向1mol 赤热的硫化亚铜中通入足量的水蒸气,生成2mol 氢气,同时还生成金属铜和一种刺激性气味的气体。
(1)该反应的化学方程式是_______________________________________________。
(2)该反应中氧化剂是_______________
(3)每生成1 mol H2转移的电子是______________mol。
27、(7分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)写出水的电子式 。
(2)A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
26、(5分)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离 。
(2)固体和液体的分离 。
(3)含固体溶质的溶液中除去部分溶剂 。
(4)胶体中分离出可溶电解质 。
(5)几种沸点相差较大的互溶液体的分离 。
25. 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.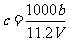 B.
B.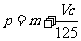 C.n=m+17Vc D.
C.n=m+17Vc D. 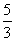 <<
<<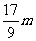
第Ⅱ卷(非选择题,共50分)
二,填空题:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com