
9.已知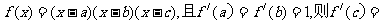 ( )
( )
A. 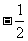 B.
B. C.1
D.
C.1
D. 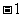
8.如图,点E为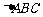 中 AB边的中点,点F为AC的三等分点(靠近点A),BF交CE于点G,若
中 AB边的中点,点F为AC的三等分点(靠近点A),BF交CE于点G,若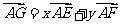 ,则
,则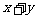 等于( )
等于( )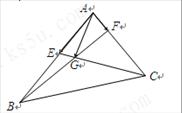
A.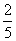 B.
B.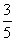
C.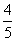 D.
D.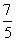
7.已知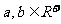 ,且满足
,且满足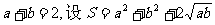 的最大值是 ( )
的最大值是 ( )
A.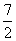 B.4 C.
B.4 C.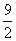 D.5
D.5
6.命题p:若a 、b∈R,则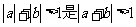 的充分而不必要条件;命题q:函数
的充分而不必要条件;命题q:函数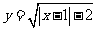 的定义域是
的定义域是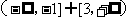 ,则( )
,则( )
A.p或q为假 B.p且q为真 C.p真q假 D.p假q真
5.要得到函数y = sin(2x-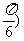 的图像,只需将函数y = cos 2x的图像( )
的图像,只需将函数y = cos 2x的图像( )
A. 向右平移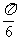 个单位
B. 向右平移
个单位
B. 向右平移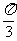 个单位
个单位
C. 向左平移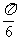 个单位
D. 向左平移
个单位
D. 向左平移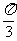 个单位
个单位
4.已知e<x<10,记a=ln(lnx),b=lg(lgx),c=ln(lgx),d=lg(lnx),则a,b,c,d的大小关系( )
A.a<b<c<d B.c<d<a<b C.c<b<d<a D.b<d<c<a
3.已知函数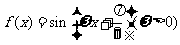 的最小正周期为
的最小正周期为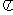 ,则该函数的图象( )
,则该函数的图象( )
A.关于点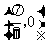 对称 B.关于直线
对称 B.关于直线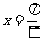 对称
对称
C.关于点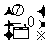 对称 D.关于直线
对称 D.关于直线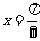 对称
对称
2.已知等差数列{  }满足:
}满足: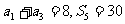 ,若等比数列{
,若等比数列{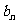 }满足
}满足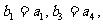 则
则
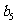 为 ( )
为 ( )
A.16 B.32 C.64 D.27
1.设复数z满足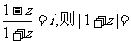 ( )
( )
A.0 B.1 C.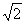 D.2
D.2
22、右图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
A. 该反应的热化学方程式为:N2
+ 3H2  2NH3,
△H = -92kJ·mol-1
2NH3,
△H = -92kJ·mol-1
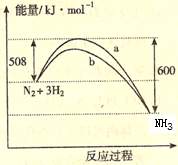 B. a曲线是加入催化剂时的能量变化曲线
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂, 该化学反应的反应热改变
D. 在温度体积一定的条件下, 通入lmol N2和3molH2 反应后放出的热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
第II卷
(1)A的一种氢化物与B单质的摩尔质量相等,则A的氢化物的分子式为 ;A的另一种氢化物与B的一种氢化物的电子总数相等,实验室制取A的该气态氢化物的化学方程式为 。
(2)B与C按原子个数比1∶1所形成化合物的电子式为 。
(3)由上述五种元素中的三种组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 。
(4)D单质能与C的最高价氧化物的水化物浓溶液反应放出氢气,写出该反应的离子方程式
___________________________________写出D元素在周期表中的位置______________________
(5)E的最高价氧化物为无色液体,0.5 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式:
_____________________________________________________________________
24(14分)、将不同量的H2O(气) 和CO
气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) +
CO( g)  CO2
(g) +H2(g);得到以下三组数据,据此回答下列问题:
CO2
(g) +H2(g);得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650℃ |
1
mol |
2
mol |
0.8
mol |
1.2
mol |
5
min |
|
2 |
900℃ |
0.5
mol |
1
mol |
0.2
mol |
0.8
mol |
3
min |
|
3 |
900℃ |
a |
b |
c |
d |
t |
( 1 ) ①由以上数据,实验1中以v( CO2) 表示的反应速率为 。
②该反应在650℃时平衡常数数值为 ,该反应的逆反应为 (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t < 3min,
则a、b 应满足的关系是 。
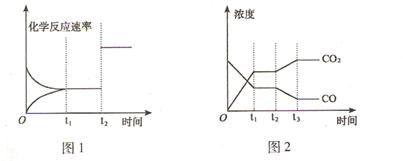 (2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的 情况: ①图1中时刻t2发生改变的所有可能的条件是
。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的 情况: ①图1中时刻t2发生改变的所有可能的条件是
。
②图2中时刻t2发生改变的所有可能的条件是 。
(3) 在850℃时,其平衡常数K = 1,850℃时在该容器中同时充入1.0molCO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向 (填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为 。
25(4分)、下面所列的是中学化学实验室中几种常见的仪器:酸式滴定管、碱式滴定管、温度计、量筒、托盘天平(附砝码)、 普通漏斗、烧杯、 玻璃棒。
① 若用称量好的NaOH固体配制500mL 0.1mol/L的NaOH溶液,还缺少的仪器和用品有______
若俯视刻度线定容,则所配溶液的浓度 (填偏大、偏小或无影响)
②用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 E. 未用标准液润洗碱式滴定管
26(7分)、已知Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
某课外小组的同学经实验分析,确定某红色粉末为Fe2O3和Cu2O的混合物。
(1) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(2)实验小组欲利用该红色粉末制取较纯净的胆矾(CuS04 · 5H20) 。经查阅资料得知:pH≥9.6时 Fe2+完全沉淀 pH≥6.4时 Cu2+完全沉淀 pH≥3.7时 Fe3+完全沉淀,实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
 实验小组设计如下实验方案:
实验小组设计如下实验方案:
试回答:
① 试剂1为 ,试剂2为 (填字母)。
② 固体X的化学式为 。
③ 操作I为 。
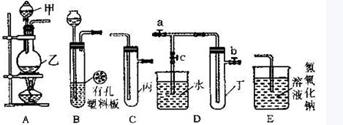 27(20分)、某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有_______________ (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分成两分,进行实验I、II两个实验,实验操作、现象、结论如下:
27(20分)、某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有_______________ (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分成两分,进行实验I、II两个实验,实验操作、现象、结论如下:
|
实验序号 |
实验操作 |
现象 |
结论 |
|
I |
将该氯水滴入品红溶液 |
|
氯气与水反应的产物有漂白性 |
|
II |
在该氯水中加入NaHCO3粉末 |
|
氯气与水反应的产物具有较强的酸性 |
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)。
|
|
甲 |
乙 |
丙 |
|
试剂 |
|
|
|
|
实验现象 |
|
|
|
|
实验结论 |
|
③ 写出A装置中有关反应的离子反应方程式:
_________________________________________________________
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。 ①B中发生反应的化学方程式为___________________________________________。
②将B中乳胶管与D中a处乳胶管相连组装仪器进行实验,欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹___________ ,再打开止水夹______ ,使烧杯中的水进入试管丁的操作是______________________________________________________
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是__________________ (气体按标准状况计算)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com