
4.(2009四川卷文)某企业生产甲、乙两种产品,已知生产每吨甲产品要用A原料3吨,B原料2吨;生产每吨乙产品要用A原料1吨,B原料3吨,销售每吨甲产品可获得利润5万元,每吨乙产品可获得利润3万元。该企业在一个生产周期内消耗A原料不超过13吨,B原料不超过18吨.那么该企业可获得最大利润是
A. 12万元 B. 20万元 C. 25万元 D. 27万元
答案 D
 解析 设生产甲产品
解析 设生产甲产品 吨,生产乙产品
吨,生产乙产品 吨,则有关系:
吨,则有关系:
|
|
A原料 |
B原料 |
甲产品 吨 吨 |
3 |
2 |
乙产品 吨 吨 |
 |
3 |
则有:
目标函数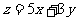
作出可行域后求出可行域边界上各端点的坐标,经验证知:
当 =3,
=3, =5时可获得最大利润为27万元,故选D
=5时可获得最大利润为27万元,故选D
3.(2009安徽卷文)不等式组 所表示的平面区域的面积等于
A. B.
B. C.
C. D.
D.
解析
由 可得
可得 ,故
,故 阴 =
阴 = ,选C。
,选C。
答案 C
2.(2009安徽卷理)若不等式组 所表示的平面区域被直线
所表示的平面区域被直线 分为面积相等的两部分,则
分为面积相等的两部分,则 的值是
的值是
A. B.
B.  C.
C. D.
D. 
答案 B
 解析 不等式表示的平面区域如图所示阴影部分△ABC
解析 不等式表示的平面区域如图所示阴影部分△ABC
由 得A(1,1),又B(0,4),C(0,
得A(1,1),又B(0,4),C(0, )
)
∴ △ABC=
△ABC= ,设
,设 与
与 的
的
交点为D,则由 知
知 ,∴
,∴
 ∴
∴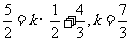 选A。
选A。
1. (2009山东卷理)设x,y满足约束条件
(2009山东卷理)设x,y满足约束条件 ,
,
若目标函数z=ax+by(a>0,b>0)的是最大值为12,
则 的最小值为 ( ).
的最小值为 ( ).
A. B.
B. C.
C.  D.
4
D.
4
答案 A
解析 不等式表示的平面区域如图所示阴影部分,当直线ax+by= z(a>0,b>0)
过直线x-y+2=0与直线3x-y-6=0的交点(4,6)时,
目标函数z=ax+by(a>0,b>0)取得最大12,
即4a+6b=12,即2a+3b=6, 而 =
= ,故选A.
,故选A.
[命题立意]:本题综合地考查了线性规划问题和由基本不等式求函数的最值问题.要求能准确地画出不等式表示的平面区域,并且能够求得目标函数的最值,对于形如已知2a+3b=6,求 的最小值常用乘积进而用基本不等式解答.
的最小值常用乘积进而用基本不等式解答.
1.整体把握。
父亲的来信仅仅是一封信吗?
[解题指导]这道题目考查的是对文中“父亲”行为的深刻理解,理解了这一点,才能真正理解作者为什么写这篇文章。回答时,要结合上下文来理解“父亲”“来信”的深意。“儿行千里母担忧”,“我”最初的“平静”和后文的“泪流满面”形成了鲜明的对比--原来父亲的来信已经超越了来信行为的本身,这是父亲对自己关爱的一种特殊方式。
[解题误区]对父亲来信行为理解不深,就可能理解成只是一般的来信问候。
近几年高考几乎每年都设置判断离子共存问题的试题。从历年高考中有关离子共存问题的难度上分析,这类问题都属于中等难度偏易题,但这类题的区分度都比较高。离子共存与离子反应是一个问题的两个方面,离子不能共存必然是离子反应发生的结果,讨论离子共存也就是对离子反应发生条件的判断。另外,离子共存问题又比较综合,往往涉及多种离子之间的反应,有时还要考虑环境因素的影响。
例4.在pH=1的无色透明溶液中不能大量共存的离子组是( )
A.Al3+ Ag+ NO3- Cl- B.Mg2+ NH4+ NO3- Cl-
C.Ba2+ K+ S2- Cl- D.Zn2+ Na+ NO3- SO42-
答案:AC
解题说明:1.首先从化学基本理论和概念出发,理清离子反应的规律和“离子共存”的条件。在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化反应,以及在一定条件下一些微粒(离子、分子)可形成络合离子等。“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出。因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理。2.审题时应注意题中给出的附加条件:(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-的浓度为
1×10-10mol/L的溶液等。(2)有色离子MnO4-(紫色)、Fe3+(黄色)、Cu2+(蓝色)、Fe2+(浅绿色)、Fe(SCN)2+(血红色)。(3)MnO4-,NO3-等在酸性条件下具有强氧化性。(4)S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O (5)注意题目要求“大量共存”还是“不能大量共存”。3.审题还应特别注意以下几点:(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4- 与Cl-在强酸性条件也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
4.离子反应的应用
(1)物质检验与含量测定:只要对其中特定的离子进行检验或测定即可,不必对物质的所有构成离子进行检验和测定。定量测定的方法包括酸碱中和滴定法、氧化还原滴定法、沉淀滴定法、络合滴定法等。
附:常见离子的检验
|
离子 |
所用试剂或操作 |
现象 |
相关方程式 |
|
NH4+ |
加浓碱液、△ |
产生刺激性气味气体,且使湿润红色石蕊试纸变蓝 |
NH4+ + OH– NH3↑+ H2O
NH3↑+ H2O |
|
Mg2+ |
加过量NaOH溶液 |
产生白色沉淀 |
Mg2+ + 2OH– = Mg(OH)2↓ |
|
Al3+ |
加过量氨水,后加NaOH |
产生白色沉淀,加NaOH时沉淀溶解 |
Al3++3NH3•H2O = Al(OH)3↓+3NH4+ Al(OH)3+ OH–= [Al(OH)4]-+ 2H2O |
|
Fe2+ |
加NaOH溶液 |
产生白色沉淀,后迅速变灰绿,最终变红褐色沉淀 |
Fe2+ + 2OH– = Fe (OH)2↓ 4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3 |
|
Fe3+ |
加KSCN溶液 |
溶液变血红色 |
Fe3+ + SCN– = [Fe(SCN)]2+ |
|
Ag+ |
加NaCl溶液,后加稀HNO3 |
产物白色↓,加稀HNO3后不溶 |
Ag+ + Cl– = AgCl↓ |
|
Cl– |
加稀HNO3酸化的AgNO3溶液 |
产生白色沉淀 |
Ag+ + Cl– = AgCl↓ |
|
Br– |
加稀HNO3酸化的AgNO3溶液 |
产生淡黄色沉淀 |
Ag+ + Br– = AgBr↓ |
|
I– |
加稀HNO3酸化的AgNO3溶液 |
产生黄色沉淀 |
Ag+ + I– =AgI↓ |
|
SO42– |
加HCl酸化的BaCl2 |
产生白色沉淀 |
Ba2++SO42–= BaSO4↓ |
|
SO32– |
加盐酸后,产生气体,通入品红试液,加热 |
产生无色刺激性气味气体,且使品红试液褪色,加热后恢复原色 |
2H++ SO32–=SO2↑+H2O |
|
NO3– |
加Cu和浓H2SO4,加热浓缩 |
产生红棕色气体,溶液变蓝 |
Cu+2H2SO4(浓)+2NaNO3 CuSO4+Na2SO4+2NO2↑+2H2O CuSO4+Na2SO4+2NO2↑+2H2O |
|
PO43– |
加AgNO3溶液,后加稀HNO3 |
产生黄沉淀,加酸后沉淀溶解 |
3Ag++ PO43–=
Ag3PO4↓Ag3PO4+3H+=3Ag++H3PO4 |
|
CO32– |
加盐酸后,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2H++CO32–=CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
|
HCO3– |
加热,产生的气体通入澄清石灰水 |
产生无色气体,此气体能使澄清石灰水变浑浊 |
2NaHCO3 Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O Na2CO3+CO2↑+H2O Ca2++2OH–+CO2=CaCO3↓+H2O |
(2)物质的制备与纯化
(3)生活中的应用
3.离子反应方程式
离子反应方程式是用实际参加反应的离子所表示的在溶液中进行的反应,它体现了某一类反应的实质。
离子反应方程式的书写有如下两种不同的方法:
(1)"写、拆、删、查"四步法
①先写出正确的化学反应方程式。
②将方程式两边易溶于水易电离的强电解质改写成离子,单质、氧化物、沉淀、气体、弱电解质、非电解质则保留化学式。微溶于水的强电解质,若以溶液的形式存在,则改写为离子,若以浊液的形式存在,则应保留化学式;H2SO3、H3PO4通常也保留化学式。
③HSO4-可以拆写为H+和SO42-,也可以不拆写,多元弱酸的酸式酸根离子,一律不能拆写。如:HCO3-、H2PO4-、HPO42-、HS-等。
④删除两边没有参加反应的离子,化简各物质的系数成最简整数比,检查方程式两边各原子数是否平衡,电荷总数是否平衡。
(2)离子反应实质法
①分析反应物在水溶液中的存在形式。易溶于水、易电离的反应物写出其电离方程式;难溶于水、气体、难电离的物质写化学式。
②判断反应物存在形式的微粒哪些能相互作用生成沉淀、水、气体或者发生氧化还原反应。
③综合上述两步写出离子方程式并配平。
例3.下列离子方程式中不正确的是( ) A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ B.碘化钾溶液跟适量溴水反应:2I-+Br2=I2+2Br- C.将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ D.将氯气通入氯化亚铁溶液中:2Fe2++Cl2=2Fe3++2Cl-
解析:检查离子反应方程式的书写是否正确是高考中的常见题型,考生应从如下四个方面展开思考:①明确哪些物质能“拆”,可写成离子形式(如A选项中的Ca(HCO3)2是易溶于水易电离的盐),哪些物质不能“拆”,必须写化学式; ②检查离子方程式是否配平时,要注意原子守恒和电荷守恒(C项方程式两边的电荷不守恒);③看反应是否能发生及是否符合反应的实际;④要有“量”的概念,即:一定物质的量的物质溶于水时电离出离子的种类及物质的量,发生反应的离子种类和物质的量。
答案:AC
2.离子反应的发生条件
(1)生成沉淀:熟悉常见物质的溶解性,如Ba2+、Ca2+、Mg2+与SO42-、CO32-等反应生成沉淀Ba2++CO32-=CaCO3↓、Ca2++SO42-=CaSO4(微溶);Cu2+、Fe3+等与OH-也反应生成沉淀如
Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等
(2)生成弱电解质:如OH-、CH3COO-、PO43-、HPO42-、H2PO4-等与H+发生反应: OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根与OH- 反应:HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O;NH4++OH-=NH3·H2O等。
(3)生成气体(挥发性物质):如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+ 常生成气体CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
(4)发生氧化还原反应:具有较强还原性的离子与具有较强氧化性的离子如I-和Fe3+ 发生2I-+2Fe3+=I2+2Fe2+;在酸性或碱性的介质中由于发生氧化还原反应如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共存。在原电池、电解池中的离子反应也属于这一类型。
(5)其它条件
还应注意有少数离子可形成络合离子的情况。如Fe3+和SCN-、C6H5O-,发生如下络合反应
Fe3++SCN- [Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。
[Fe(SCN)]2+;能水解的阳离子跟能水解的阴离子(如Al3+和HCO3-、CO32-、HS-、S2-、ClO-)在水溶液中也能发生反应等。
1.概念:溶液中离子之间,以及离子与原子或分子之间发生的反应称为离子反应。离子反应的共同特点是某种或某些离子浓度的降低。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com