
4.(2000年高考科研试测题)下表所列数据是在某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚Y/nm |
0.05a |
0.20a |
0.45a |
0.80a |
1.25a |
|
NiO层厚Y’/nm |
b |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数
请填空回答:
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是
。
(2)金属氧化膜的膜厚Y跟时间t所呈现的关系是(填“直线”或“抛物线”,“对数”或“双曲线”等类型):MgO氧化膜膜厚Y属 型,NiO氧化膜膜厚Y’属
型。
(3)Mg与Ni相比较,金属 具有更良好的耐高温氧化腐蚀性,其理由是 。
(该题考查学生获取、分析和处理图表信息的能力及应用数学工具解决化学问题的能力,体现了学生的综合素质。答题时要综合运用化学和数学的某些基本知识,从实验数据出发,建立数学模型(定量规律),进而从物质内部结构作出解释,这是化学研究问题常用的一种方法。)
新活题网站
3.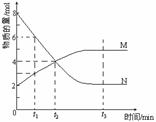 (2001年全国高考题)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
(2001年全国高考题)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
A.反应的化学方程式:2M  N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
(本题以化学反应速率与化学平衡为素材,考查观察图象及其信息加工的能力。答题时要仔细地识图和析图,对速率与平衡的规律加以运用。)
2.(2000年广东高考题)用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
(该题旨在考查学生对影响化学反应速率因素的掌握情况。答题时要综合考虑多方面的因素,注意反应的本质。)
1.反应4A(s)+3B(g) 2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
(本题考查学生对反应速率的理解及表示方法。答题时注意是用何种物质表示反应速率的,指的是平均速率还是瞬时速率。)
3.外界条件对反应速率的影响,可以概括为“加加、减减”四个字,即增加浓度、增加(升高)温度、增加压强、增加(使用正)催化剂,均可以增大化学反应速率;减小浓度、减小(降低)温度、减小压强、减小(使用负)催化剂,均可以减小化学反应速率。
典型题点击
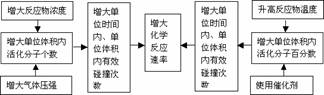
2.影响化学反应速率的因素
(1)内因(主要因素):参加反应物质的性质。
(2)同一化学反应的速率大小与外界条件(外因)有关。具体规律如下:
1.化学反应速率表示法
(1)意义:研究化学反应进行的快慢问题。
(2)表示方法:常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。单位:mol·(L·min)-1或mol·(L·s)-1。
(3)注意问题
①随着反应的进行,物质浓度不断变化,反应速率也不断变化,因此某一段时间的反应速率实际是平均速率,而不是瞬时速率。
②同一反应里,用不同物质表示的化学反应速率之比,等于它们在化学方程式中的化学计量数之比,也等于同一时间内各物质的浓度变化之比。表示化学反应速率时,应注 明是用哪种物质表示的化学反应速率。
③化学反应速率在不同的时间间隔内不一定相等。
④对于没有达到化学平衡状态的可逆反应:v(正)≠v(逆)
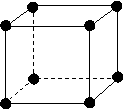
16.⑴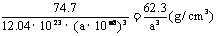
⑵n(Ni3+):n(Ni2+)=6:91
讲析:⑴如图所示,以立方体作为计算单元,此结构中含有Ni2+-O2-离子数为:4×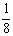 =
=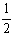 (个),所以1molNiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1molNiO晶体中应含有此结构的数目为6.02×1023÷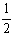 =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量 为74.7g/mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3,所以1molNiO的体积应为12.04×1023×(a×10-8cm)3,NiO的摩尔质量 为74.7g/mol,所以NiO晶体的密度为
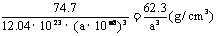
⑵解法一(列方程):设1molNi0.97O中含Ni3+为xmol,Ni2+为ymol,则得
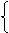 x+y=0.97 (Ni原子个数守恒)
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06,y=0.91,故n(Ni3+):n(Ni2+)=6:91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
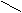
 Ni3+ 3
0.06/0.97
Ni3+ 3
0.06/0.97
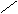
 2/0.97
2/0.97
Ni2+ 2 0.91/0.97
故n(Ni3+):n(Ni2+)=6:91。
15.(1)C 第二周期第ⅣA族 (2)CCl4 正四面体 109°28’ (3)CO2 直线型 180° (4)灭火剂和有机溶剂
14.(1)H O Na S (2)SO3 H2O2 Na2O2 (3)NaHSO3 NaHSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com