
6.电子守恒规律的应用
(1)根据电子得失数相等,进行部分氧化(还原)的相关计算;
(2)根据电子得失数相等,推断氧化还原反应中化合价变化情况,或推断产物;
(3)根据电子得失数相等,求某一反应中被氧化与被还原的原子数之比;
(4)根据电子得失数相等,进行电解产物计算。
典型题点击
5.氧化性、还原性强弱的判断与应用
(1)根据几个化学方程式,排列氧化剂(还原剂)的氧化性(还原性)强弱顺序;
(2)根据溶液中的置换反应、原电池电极反应,判断金属的还原性(或金属性)强弱顺序;
(3)根据物质氧化性、还原性的强弱顺序,判断某一反应能否进行,或选择某一反应的氧化剂(还原剂)
4.氧化还原反应的典型计算:依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
3.配平氧化还原反应方程式,判断氧化还原反应电子转移的方向和数目。
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数
方法步骤:划好价、列变化、求总数、配系数。
2.氧化还原反应规律,氧化性或还原性强弱比较规律。在同一氧化还原反应中,氧化性强弱顺序:氧化剂 > 氧化产物 ; 还原性强弱顺序:还原剂 > 还原产物
1.氧化和还原、氧化性和还原性、氧化剂和还原剂等概念。元素处于最高价,只有氧化性;处于最低价时,只有还原性;处于中间价态时,既有氧化性又有还原性。概念可简记为“升-失-氧-还;降-得-还-氧”再进行理解。
17.化肥厂有一个制取水煤气的生产工艺:
C(s)+H2O(l)= CO (g)+H2 (g);ΔH=+131kJ/mol
C(s)+ O2(g)= CO2(g);ΔH=-393kJ/mol
假定要得到2000Kg水煤气,理论上要多少千克空气才能使炉温回到原来的温度?
16.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是两种原子间形成1mol化学键时释放的能量或断开1mol化学键时所吸收的能量。现提供以下化学键的键能(kJ/mol)P-P:198 P-O:360 O=O:498 P=O:585
试根据这些数据,计算以下反应的Q
P4(白磷)(g) + 5O2(g) = P4O10(g); ΔH=-Q kJ/mol
(提示:白磷是正四面体型的分子,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键结合一个氧原子)
15.已知X为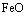 和
和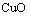 的混合物,取两份等质量的X样品进行下列实验:
的混合物,取两份等质量的X样品进行下列实验:

固体 酸性溶液 无色气体
(1)写出①、②和③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为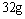 ,溶液E中只含有一种金属离子,气体F在标准状况下体积为
,溶液E中只含有一种金属离子,气体F在标准状况下体积为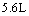 ,试计算取用的每份X的质量和X中
,试计算取用的每份X的质量和X中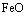 和
和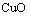 的质量比。
的质量比。
14.1mol气态钠离子和1mol气态氯离子结合生成1mol 氯化钠晶体所释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是 。
A.Na+(g) + Cl-(g) = NaCl(s) ΔH
B.Na(s) +1/2Cl2(g)=NaCl(s) ΔH1
C.Na(s)= Na(g) ΔH2
D.Na(g) -e-= Na+(g) ΔH3
E.1/2Cl2(g) =Cl(g) ΔH4
F.Cl(g)+ e-= Cl-(g) ΔH5
(2)写出ΔH1与ΔH、ΔH2、ΔH3、ΔH4、ΔH5之间的关系式 。
已知氧化亚铁晶体结构跟氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子的个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为ρg/cm3,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是 cm(用代数式表示)。
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将 (填“减少”、“增多”或“保持不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com