
1.不能了解物质溶解过程是物理-化学过程。
17.某化学课外小组用铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式 ;
(2)现用1kg这种废铜屑理论上能制取胆矾多少千克?
(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液:①此波尔多液中Cu2+离子和Ca2+离子的物质的量比为 (最简整数比).
②波尔多液有效成分的化学式可表示CuSO4•••••xCu(OH)2•••yCa(OH)2,此种配比当x=1时,试确定y的数值。
(解题过程中注意守恒的应用)
第7课时 溶液和胶体 (B卷)
易错现象
16.在一定温度下,有x g的某铝盐溶液溶质的质量分数为a%,加入此铝盐无水物1g后恰好饱和,溶液的溶质质量分数为b%。
(1)写出x值的关系式(用a、b表示);
(2)求该温度下铝盐的溶解度;
(3)若此铝盐相对分子质量为M,饱和溶液密度为d g•cm-3,又知1mol此铝盐能电离出5mol离子,则阴离子的物质的量浓度为多少?
(本题重点考查几种化学量的理解和应用)
15。下面是四种盐在不同温度下的溶解度(g/100gH2O)
|
温度 |
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.8 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:①盐类共存时不影响各自的溶解度。②分离晶体时,溶剂的损耗忽略不计。)
某同学设计用物质的量比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图

(1) 在①和③的实验过程中,实验的关键条件是 ;
(2) 分离出晶体的②和④的操作是 (填倾倒、蒸发、结晶、过滤中的某种操作)。硝酸钾是晶体 (填A或C)。
(3) 粗产品中可能含有杂质离子是 ;检验方法是
;
(4) 欲将粗产品提纯,可采取的方法是 。
14.在配制一定量的物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低还是不变?
(1)用量筒筒取液态溶质读数时俯视量筒,所配溶液浓度 ;
(2)将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液浓度 ;
(3)定容摇匀后,有少量溶液外流,所配溶液浓度 。
13.某硫酸盐RSO4在t℃时溶解度为31.75g。在t℃时取足量的RSO4饱和溶液,向其中加入8.00g RSO4后,析出24.6g RSO4·7H2O晶体,则R为 ( )
A.Zn B.Cu C.Fe D.Mg
12.某温度下,向盐A的饱和溶液(质量分数为a%)中加入m g无水盐A,同温下析出n g A·xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M) ( )
A.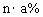 B.n-m
B.n-m
C.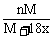 D.
D.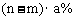
(注意由于温度不变,减少了的溶液也是该温度下的饱和溶液且饱和溶液的浓度不变)
11.有W1gKCl饱和溶液,其质量分数为C1%,采取某种措施后析出mgKCl晶体(不含结晶水),母液质量为W2g,质量分数为C2%。则下列关系正确的是 ( )
A.C1一定大于C2 B.W1·C1-W2·C2 =100m
C.W1 >W2 + m D.原条件下KCl的溶解度小于C1g
(注意对“某种措施”的讨论及溶质质量的恒定)
10.已知某饱和溶液的①溶液的质量(m液),②溶剂的质量(m剂),③溶液的体积(V液),④溶质摩尔质量(M质),⑤溶质溶解度(S质),⑥溶质的密度(ρ液)。以上条件的组合中,不能用来计算饱和溶液的物质的量浓度的是( )
A.①、②、③、④ B. ①、③、④、⑤
C. ④、⑤ 、⑥ D. ①、③、④
(本题重点考查溶质质量分数与物质的量浓度之间的换算,解题过程中注意其理解运用)
9.常温下将0.1mol下列物质分别投入90g水中充分混合,①CaO、②NaOH、③Na2O、④Na2O2。所得溶液质量分数排列顺序正确的是 ( )
A.③=④>②>① B.①>④=③>②
C.④>③>②>① D.③>④>②>①
(解题过程中注意氢氧化钙的微溶性)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com