
17. ①三 IA  ②H2CO3
、NaOH、
②H2CO3
、NaOH、
Al(OH)3 、H2SO4、HClO4
③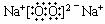 2Na2O2+2CO2 = 2Na2CO3+O2
2Na2O2+2CO2 = 2Na2CO3+O2
④ Al(OH)3 Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
16. X-n X+m X-m X+n 85 55 讲析:若A、B同在第IA族相邻时,两者原子序数相差上一周期元素种类;若A、B同在第VIIA族相邻时,两者原子序数相差下一周期元素种类。
15.⑴ N ③; ⑵ Sn ④; ⑶ Fe ①
10.BC 11.A 12.C 13.BD 14.D
讲析:1.氢元素也可以得到1个电子表现出-1价,与卤素的性质相似,故而可排在VII族。 2.由题意可知X为Si,单质为原子晶体符号题意 4.在A、B、C.D四种元素中,同周期 的两元素原子序数之和为2x,又因同主族各周期的元素之间原子序数相差8、18或32。所以四种元素中,同主族的两元素的原子序数之和为2x或 2x+10或 2x+14。所以四种元素的原子序数之和可能为: 4X、4X+10、4X+14三种情况。 5.逐一代入讨论,选项C符合题意。 6. 相同物质的量的原子获得相同物质的量的电子时释放出的能量越多,该原子越活泼,形成的离子越稳定。 7.最外层电子数小于6且是2的整数倍的元素是Si。 8.定位讨论得A为C、B为Mg、C为Si。 9.符合选项B的化合物可以是HCHO,选项C可以是HCOOH, 选项D则可以是H2CO3。 11.相邻两主族的原子序数之差必为奇数。 12.镭是第IIA族中金属性最强的元素,氢氧化镭为强碱。 13. 第七周期排满时的最后一种元素为稀有气体元素,但也能与其它物质发生化学反应。 14.分析A的化合价可能是+2和+4,故选项D符合题意。
1.C 2.B 3.C 4.B 5.C 6.D 7.AC 8.BC 9.A
3.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
I |
|
|
|
B |
|
|
|
|
|
|
|
C |
D |
J |
|
G |
|
E |
|
|
|
|
|
|
|
|
H |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
讲析:首先根据实验得出的性质,可将十种元素大致划分为四组:A和E,B、F、G和H,C和I,D和J。再根据相对原子质量的大小,排出它们是左右关系还是上下关系,便不难得出答案。
检测提高
1.C 2.D
讲析:1.物质熔点比较与晶体类型有关;主族元素最高正价=族序数;非金属元素气态氢化物水溶液的酸性应分同周期和同主族两种情况来讨论;非金属元素对应阴离子的还原性与其非金属性相反,而最高价氧化物的水化物的酸性与其非金属性相同。 2.根据化学式分析化合价为+3、-1或+6、-2,再定位讨论;另外要考虑特例如PH3、NH3和PCl3。
14.⑴98 ⑵  讲析:设R的化合价为-x,R的相对原子质量为y。联列方程组讨论分析得出结论。
讲析:设R的化合价为-x,R的相对原子质量为y。联列方程组讨论分析得出结论。
第9课时 (B卷)
纠错训练
13. ⑴H N O Na ⑵
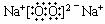 ⑶NH4NO3
⑶NH4NO3
NH4+
+ OH-  NH3↑
+ H2O
NH3↑
+ H2O
讲析:定位讨论,X必在第一周期为H,W则必在第三周期为Na,Y、Z在第二周期。
11.⑴188O ⑵VIII ⑶17 ⑷六、七
|
 12. ⑴ CaF2 , CS2 ⑵ MgS ⑶ NaOH 或 LiHS ⑷ H2b-mXOb ⑸ KCl 或CaCl2
讲析: BeCl2
的化合物类型不作要求。
12. ⑴ CaF2 , CS2 ⑵ MgS ⑶ NaOH 或 LiHS ⑷ H2b-mXOb ⑸ KCl 或CaCl2
讲析: BeCl2
的化合物类型不作要求。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com