
5. .在粗糙水平地面上与墙平行放着一个截面为半圆的柱状物体A,
A与竖直墙之间放一光滑圆球B,整个装置处于静止状态。现对B加一竖直向下的力F,F的作用线通过球心,设墙对B的作用力为F1,B对A的作用力为F2,地面对A的作用力为F3。若F缓慢增大而整个装置仍保持静止,截面如图所示,在此过程中
.在粗糙水平地面上与墙平行放着一个截面为半圆的柱状物体A,
A与竖直墙之间放一光滑圆球B,整个装置处于静止状态。现对B加一竖直向下的力F,F的作用线通过球心,设墙对B的作用力为F1,B对A的作用力为F2,地面对A的作用力为F3。若F缓慢增大而整个装置仍保持静止,截面如图所示,在此过程中
A. F1保持不变,F3缓慢增大 B. F1缓慢幼大,F3保持不变 C. F2缓慢增大,F3缓慢增大 D. F2缓慢增大,F3保持不变
4.竖直绝缘壁上的Q点有一固定的质点A,在Q的正下方P点用丝线悬挂另一质点B,已知PA=PB,A、B两质点因带电而互相排斥,致使悬线和竖直方向成θ角,(如图所示),由于漏电使A、B两质点的带电量逐渐减少,在电荷漏完之前悬线对悬点P的拉力大小。则( )
A、逐渐减小
B、逐渐增大
C、保持不变
D、先变小后变大
3. 如图所示,小木块放在倾角为α的斜面上,受到一个水平力F(F≠0)的作用处于静止,如图所示,则小木块受到斜面的支持力和摩擦力的合力的方向与竖直向上的方向的夹角β可能是( )
如图所示,小木块放在倾角为α的斜面上,受到一个水平力F(F≠0)的作用处于静止,如图所示,则小木块受到斜面的支持力和摩擦力的合力的方向与竖直向上的方向的夹角β可能是( )
A. β=0
B. 合力的方向向右上方,β<α
C. 合力的方向向左上方,β<α
D. 合力的方向向左上方,β>α

2.如图所示,质量为M的物体,在与竖直线成θ角,大小为F的恒力作用下,沿竖直墙壁匀速下滑,物体与墙壁间的动摩擦因数为μ,则物体受到的摩擦力大小的下列结论中正确的是 ( )
 ①Mg-Fcosθ; ②μMg+Fcosθ;
①Mg-Fcosθ; ②μMg+Fcosθ;
③μFsinθ; ④μ(Mg-Fcosθ)。
A.①③ B.②④
C.①② D.③④
1.木块A、B分别重50 N和60 N,它们与水平地面之间的动摩擦因数均为0.25;夹在A、B之间的轻弹簧被压缩2㎝,弹簧的劲度系数为400N/m.系统置于水平地面上静止不动。现用F=1 N的水平拉力作用在木块B上..力F作用后 ( )
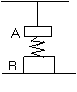 A.木块A所受摩擦力大小是12.5 N
A.木块A所受摩擦力大小是12.5 N
B.木块A所受摩擦力大小是11.5 N C.木块B所受摩擦力大小是9 N D.木块B所受摩擦力大小是7 N
14.(09宁夏卷 37)
37) 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)

 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①图中X、Y分别是_____、_____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_____;
①图中X、Y分别是_____、_____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_____;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:_____;
 ③这样设计的主要节(电)能之处在于________
____、________ ____。
③这样设计的主要节(电)能之处在于________
____、________ ____。
13.(09海南卷 20)
20)
 (1)下列使用化肥、农药的描述中正确的是( )
(1)下列使用化肥、农药的描述中正确的是( )
 A.高温多雨时比较适合施用钾肥
A.高温多雨时比较适合施用钾肥  B.长期施用硫铵会造成土壤板结
B.长期施用硫铵会造成土壤板结
 C.石硫合剂必须与硫酸混合后才能施用
C.石硫合剂必须与硫酸混合后才能施用  D.过磷酸钙必须经硫酸处理后才能施用
D.过磷酸钙必须经硫酸处理后才能施用
 (2)下列有关硬水及其软化的说法中错误的是( )
(2)下列有关硬水及其软化的说法中错误的是( )
 A.离子交换法可以软化硬水
A.离子交换法可以软化硬水
 B.硬水中含有较多Ca2+、Mg2+
B.硬水中含有较多Ca2+、Mg2+
 C.生产、生活使用的天然水必须经软化
C.生产、生活使用的天然水必须经软化  D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀

 (3)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
(3)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 ①氨催化氧化的化学方程式为:
①氨催化氧化的化学方程式为:
 ②原料气中空气必须过量,其主要原因是;
②原料气中空气必须过量,其主要原因是;
 ③将铂铑合金做成薄丝网的主要原因是;
③将铂铑合金做成薄丝网的主要原因是;
 ④水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
、
④水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
、
12.(09海南卷 14)
14)


 汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
 (1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为 ,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由 能转化为 能,最终转化为机械能;
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为 ,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由 能转化为 能,最终转化为机械能;
 (2)通过车用燃油的精炼加工处理,可减少汽车尾气中的 (填化学式,多填本空不得分)排放;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的 (填化学式,多填本空不得分)排放;
 (3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
。
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
。
11.(09北京卷26)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I从废液中提纯并结晶处FeSO4·7H2O; II将FeSO4·7 H2O配制成溶液
Ⅲ将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含的FeCO3浊液
IV将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体
V煅烧FeCO3,得到Fe2O3固体;已知:NH4HCO3在热水中分解。
⑴I中,加足量的铁屑出去废液中的Fe3+,该反应的离子方程式是
⑵II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
⑶III中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
⑷ IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-操作是是 。
⑸已知煅烧FeCO3的化学方程式是 ,现煅烧464.0kg的FeCO3,得到316.8kg产品,若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。
,现煅烧464.0kg的FeCO3,得到316.8kg产品,若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。
10.(09江苏卷 17)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
17)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
(填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
(填字母)。
 A、热裂解形成燃油 B、露天焚烧
A、热裂解形成燃油 B、露天焚烧  C、作为有机复合建筑材料的原料 D、直接填埋
C、作为有机复合建筑材料的原料 D、直接填埋
 (2)用
(2)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

 ====
====


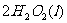 ====
====


 ====
====

 在
在 溶液中
溶液中 与
与 反应生成
反应生成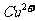 和
和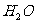 的热化学方程式为
。
的热化学方程式为
。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。


 w
w
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( ( ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com