
15、实验表明:半径为R的肥皂泡内外压强差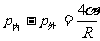 ,式中α是常量,反映了液体内部分子力所
,式中α是常量,反映了液体内部分子力所
引起的液体表面张力性质,称为表面张力系数。右图为由空心U形管连接的两个大小不同的肥皂泡,
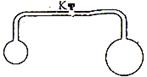 K是阀门。打开阀门K,则
K是阀门。打开阀门K,则
A、小肥皂泡越来越小,大肥皂泡越来越大,直到小肥皂泡消失
B、小肥皂泡越来越大,大肥皂泡越来越小,直到两者大小相同
C、小肥皂泡越来越小,大肥皂泡越来越大,直到两者都消失
D、小肥皂泡越来越大,大肥皂泡越来越小,直到两者都爆裂
14、下列说法中正确的是:
A、卢瑟福通过实验发现了质子的核反应方程为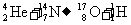
B、铀核裂变的核反应是: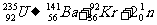
C、原子从a能级状态跃迁到b能级状态时发射波长为λ1的光子;原子从b能级状态跃迁到c能级状态时吸收波长为λ2的光子,已知λ1>λ2.那么原子从a能级状态跃迁到c能级状态时将要吸收波长为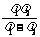 的光子
的光子
D、处于基态的氢原子在某单色光束照射下,能发出频率为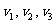 的三种光,且
的三种光,且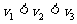
则该照射光的光子能量为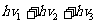
13、某二元酸(H2A)按下式发生电离:H2A = H++HA-;HA- = H++A2-。关于下列四种溶液的说法正确是
①0.01mol/L的H2A溶液 ②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A、四种溶液中c(HA-)浓度大小:③>①>②>④
B、溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-)
C、溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+)
D、溶液③中有关离子浓度关系:c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
12、锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6L(标准状况)。
将反应后的溶液稀释至1 L,测得溶液的pH=1,下列叙述不正确的是
A、反应中共消耗1.8 mol H2SO 4 B、气体甲中SO2与H2的体积比为4:1
4 B、气体甲中SO2与H2的体积比为4:1
C、反应中共消耗97.5 g Zn D、反应中共转移3 mol电子
11、燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是
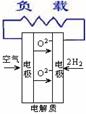
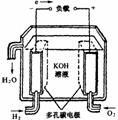
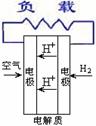
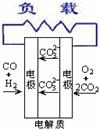
A、固体氧化物燃料电池 B、碱性燃料电池 C、质子交换膜燃料电池 D、熔融盐燃料电池
10、硝酸钾在不同温度时的溶解度如下表:
|
温度(℃) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
溶解度(g) |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
138.0 |
现有60℃时硝酸钾的饱和溶液105克,要得到39.2克晶体,应将溶液冷却到多少度
A、10℃ B、20℃ C、30℃ D、40℃
9、下列化学实验的方法和结果都正确的是
A、CH3COONa·3H2O与碱石灰混合加热可以很快制得大量的CH4
B、向碘水形成的x悬浊液中通入H2S气体至反应完全,过滤可得氢碘酸
C、将稀硫酸和乙醇的混合物加热,迅速升温至170 ℃,则可制得乙烯
D、将甲烷气体与溴蒸气混合光照后,可制得纯净的二溴甲烷
8、已知:CO2(g) + 3H2(g)
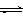 CH3OH(g) + H2O(g)
ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的
CH3OH(g) + H2O(g)
ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的
密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列
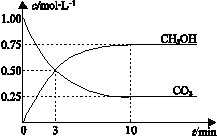 叙述中,正确的是
叙述中,正确的是
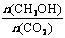 A、升高温度能使
增大
A、升高温度能使
增大
B、反应达到平衡状态时,CO2的平衡转化率为75%
C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表
示的逆反应速率
D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075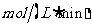
7、以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质
MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得
纯净的MnCl2 ,根据上述实验事实可推知MnS具有的相关性质是
A、具有吸附性 B、溶解度与CuS、PbS、CdS等相同
C、溶解度大于CuS、PbS、CdS D、溶解度小于CuS、PbS、CdS
6、下列叙述正确的是
①在CaCl2和NH4Cl中均既含有共价键又含有离子键;
②用蒸馏水即可鉴别甲苯、乙醇和四氯化碳三种无色液体;
③KAl(SO4)2与Ba(OH)2溶液按照溶质的物质的量之比1:2混合,充分反应后,所得溶液呈中性;
④除去混在SiO2 中的少量CaCO3可加足量盐酸并过滤。
A、①③ B、 ②④ C、 ①②④ D、②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com