
25.(3分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
某温度下,SO2(g)+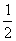 O2(g)
O2(g)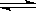 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,求该反应在该温度下平衡常数K
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,求该反应在该温度下平衡常数K
24.(14分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的含钠元素的盐,甲中含B元素,乙中含D元素,丙中含A元素。甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
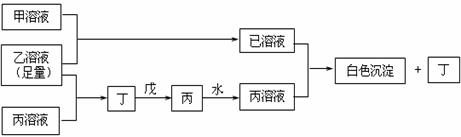
回答下列问题:
(1) B的元素符号为: ; 乙的化学式为 ;
(2)己溶液与丙溶液的反应方程式为 ;
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生反应;但生成物不是己和丁,
写出将少量的 乙溶液滴入甲溶液反应的离子方程式:
;
乙溶液滴入甲溶液反应的离子方程式:
;
(4)若用乙溶液为标准液来滴定未知浓度的丙溶液,则乙应当盛放在 滴定管中(填酸式、碱式)。若在滴定前用蒸馏水润洗锥形瓶但没有干燥,则测得的结果与真实值相比 (填偏大、相等、偏小)。若选用酚酞为指示剂,则滴定终点的产物为 。
23.(10分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。
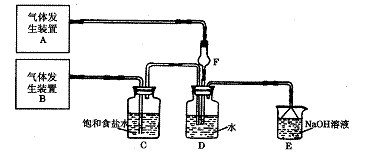
(1)D装置中主要反应的离子方程式为 ;F仪器的作用是: ;
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试液:
a 氯化铁 b 氯化亚铁c硫氰化钾 d 苯酚 e 品红 f KMnO4(H+)
若验证Cl2稍过量:取适量D中溶液滴加至盛有 (选填一个符号)试剂的试管内,再加入 (选填一个符号)试剂,发生的现象是: 。
22.(12分)如图所示,X、Y分别为外接直流电源的两极, a、b是石墨电极,通电一段时间后,a极附近溶液显红色。回答下列问题
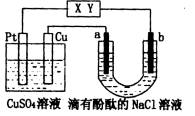
(1)Y的电极名称是 ;Cu电极的名称是 ;
(2)a的电极反应为 ;
(3)左侧装置所看到的现象为 。
21.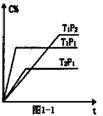 (6分)在密闭容器中投入一定量的A和B发生反应:
(6分)在密闭容器中投入一定量的A和B发生反应:
mA(g)+nB(g)  pC(g)。
pC(g)。
(1)欲使A与B的转化率等于m:n ,则起始加入A、B的
物质的量之比为 ;
(2)充入一定量的A、B,若在不同条件下C的体积分数随
时间的变化如图所示,则:m+n p(填“>”、“<”
或“=”),该反应的△H 0(“>”、“<”或“=”)。
20. 下列离子方程式的书写正确的是 ( )
下列离子方程式的书写正确的是 ( )
A.实验室用浓盐酸与MnO2反应制Cl2:
MnO2 +4HCl(浓) Cl2↑+Mn2+ +2Cl-+2H2O
Cl2↑+Mn2+ +2Cl-+2H2O
B.将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中:
2Fe2++2Br-+3Cl2 =2Fe3++6Cl-+Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++ HCO3- +OH- =CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+ =BaSO4↓+ NH3·H2O +H2O
第Ⅱ卷(非选择题共50分)
19. 在密闭容器中,对于可逆反应A
+3B
在密闭容器中,对于可逆反应A
+3B  2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是 ( )
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是 ( )
 A.若正反应方向△H <0,则T1> T 2
A.若正反应方向△H <0,则T1> T 2
B.A一定为气体
 C.压强增大时,混合气体的平均相对分子质量减小
C.压强增大时,混合气体的平均相对分子质量减小
D.B一定为气体
18.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到2molFe(OH)3沉淀,此时共消耗水的物质的量为 ( )
A.2mol B.3mol C.4mol D.5mol
17.常温时,以下4种溶液pH最大的是 ( )
A.0.01mol/L甲酸溶液
B.0.02mol/L甲酸溶液与0.02mol/L KOH溶液等体积混合后所得的溶液
C.0.03mol/L甲酸溶液与pH=12的NaOH溶液等体积混合后所得的溶液
D.甲酸溶液与NaOH溶液混合,得到C(HCOO-)= C(Na+)的溶液
16.将0.1mol·L-1的某二元弱酸(H2X)溶液和0.1mol·L-1 NaOH溶液等体积混合后(忽略混合前后溶液体积变化),下列关系式中错误的是 ( )
|
B.c(HX-)<c(X2-)
C.c(Na+)>c(HX-)
D.c(H+)+c(Na+)=c(OH-)+c(HX-)+2c(X2-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com