
20.甲、乙、丙、丁四种物质在一定条件下均能与水反应放出气体。
(1)若甲是由短周期元素形成的单质,并且该元素的原子最外电子层上的电子数为其内层电子层数的二分之一,则甲元素的原子结构示意图为_____________,甲与水反应的离子方程式为______________________________________________;
(2)乙为甲的稳定的氧化物,写出乙与水反应中氧化剂的电子式_________;19.5g乙与足量的水反应转移电子的物质的量为______mol;
(3)丙为地壳中金属元素含量排位第二的元素形成的单质,写出它与水蒸气反应的化学方程式_____________________________________________________;在实验室里,配制丙的高价氯化物溶液的操作方法:______________________________
____________________________;
解释原因并写出离子反应方程式: _________________________________________
________________________________ _________ 。
(4)丁是由两种10个电子的微粒组成的化合物,它与水反应能生成一种有刺激性气味的气体X,X分子中也含有10个电子,则丁属于___________晶体;工业上生产X时,既要增大X产量,又要提高X的产率,可采取措施是(填写下列合理选项的序数)__________。
①减压 ②降温 ③适宜的温度和压强 ④加催化剂
⑤及时从平衡体系分离出X ⑥分离出X后的原料气循环使用并补充原料
19.不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素。如相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4,c(NH4+)由大到小的顺序是 (用序号表示)。
18.下列各离子浓度的大小比较,正确的是( )
A.同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ② (NH4)2CO3 ③ (NH4)2SO4,
c(NH4+)由大到小的顺序:③>②>①
B.常温时,将等体积的盐酸与氨水混合后,pH=7,则c(NH4+)> c(Cl-)
C.0.2mol/LNa2CO3溶液中,c(OH-)= c(HCO3-)+ c(H2CO3)+ c(H+)
D.在NaHCO3溶液中离子浓度关系:c(H2CO3) > c(CO32-)
17.25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
A.Na2CO3溶液中:2c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B.0.1mol/L的NH4Cl溶液与0.05mol/LNaOH溶液等体积混合:
c(Cl-) > c(NH4+)> c(Na+) > c(OH-)> c(H+)
C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:
c(Na+)>c(NH4+)>c(SO42-) >c(OH-) = c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
16.为了配制NH4+的浓度和Cl- 的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①② B.③ C.③④ D.④
15.某温度下,密闭容器中发生反应aX(g)  bY(g) + cZ(g),达到平衡后,保持温度不变,将容器的容积压缩为原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述不正确的是
( )
bY(g) + cZ(g),达到平衡后,保持温度不变,将容器的容积压缩为原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述不正确的是
( )
A.该反应的化学方程式中化学计量数存在如下关系:a < b + c 且b = c
B.压缩容器的体积时,正反应速率、逆反应速率同时增大
C.体积压缩后,容器中气体的密度变为原来的2倍
D.达到新的平衡时,容器中的压强大于原来的2倍
14.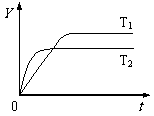 已知反应2SO2(g)+O2(g)
已知反应2SO2(g)+O2(g) 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
A.密闭容器内的压强
B.混合气体的密度
C.SO2的转化率
D.O2的体积分数
13.某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)  2E(g),若开始时只有充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起开始时减少了( )
2E(g),若开始时只有充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起开始时减少了( )
A.20% B.40% C.60% D.80%
12. 一定条件下,在体积为10 L的密闭容器中,加入1 mol X和1 mol Y进行反应:
2X(g)+Y(g) 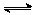 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y 的浓度相等
11.可逆反应2NO2 2NO+O2,在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2,在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n mol NO
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com