
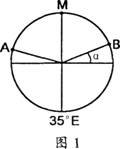
 图1为北半球某纬线圈的昼夜分割情况,其中
图1为北半球某纬线圈的昼夜分割情况,其中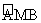 为昼弧,
为昼弧,
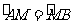 ,α等于20°,据此回答1-3题。
,α等于20°,据此回答1-3题。
1.此时,国际标准时间为 ( )
A.21时40分 B.22时20分
C.10时 D.9时40分
(一)弱氧化剂---氧化铜
1、与氨气反应:2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O
例3:已知NH3和CuO反应可得较纯净的铜、氮气和水。现利用氨的还原性来测定氨分子中各元素的质量分数,同时测定氨氧化的体积分数[在反应中生成的气体用排水法测出其体积(假设水的体积为标准状况下气体的体积)]。

(1)将图中所示装置连接成整套实验装置(填写各接口代号与字母):a接(),()接(),()接(),()接(),()接(),()接()。
(2)整套实验装置安装完毕后,检验气密性的方法是_____________。
(3)仪器连接好后进行实验,先点燃____处的酒精灯,实验结束时就撤去____处的酒精灯,且应_____再熄灭____处的酒精灯,其理由是_________。
(4)装置B的作用是__________,装置C的作用是_________,装置E的作用是_______。
解答:(1)b、c、f、g、d、e、h、i、j、k、l(d、e位置和f、g位置可以调换)
(2)点燃A处酒精灯,微热试管,若E中有气泡逸出,F中k导管内水面上升,证明气密性良好,若无此现象,证明气密性不好
(3)A、D;冷却至室温;A;防止E中的液体倒吸入c中
(4)吸收NH4HCO3分解产生的CO2和水蒸气以得到纯净的NH3;吸收CuO反应后的水蒸气;吸收CuO反应后剩余的水蒸气。
2、与乙醇反应:C2H5OH+ CuO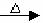 CH3CHO+ Cu+ H2O
CH3CHO+ Cu+ H2O
例4:某化学课外活动小组研究乙醇氧化实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器未画出,“Δ”表示酒精灯热源,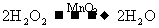
 ),每套装置又可划分为①、②、③三部分,仪器中盛放的试剂为:a为无水乙醇(沸点78℃);b为铜丝网;c为无水硫酸铜;d为新制
),每套装置又可划分为①、②、③三部分,仪器中盛放的试剂为:a为无水乙醇(沸点78℃);b为铜丝网;c为无水硫酸铜;d为新制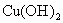 悬浊液.
悬浊液.
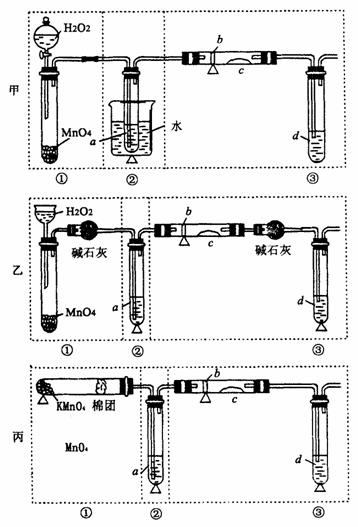
(1)写出乙醇被 催化氧化的化学方程式:_____________________________
催化氧化的化学方程式:_____________________________
(2)观察三套装置,发现乙套装置中________仪器(填仪器名称)明显选用不当.
(3)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流从左至右的顺序表示为________(例如甲①,乙②,丙③)
(4)若要保证乙醇转化为乙醛有较高的转化率,为此还需要补充的仪器是________,该仪器的作用是________
(5)实验中能够验证其产物的现象有二处,一是________________,二是___________
________
(6)装置中,若撤去第①部分,并将②中左边导管封闭其他操作不变,若无水硫酸铜无明显变化,其余现象与第(5)中相同,推断燃烧管中可能发生反应的化学方程式_____________________。
解析:(1)
(2)长颈漏斗 (3)丙①,甲②,乙③
(4)温度计 控制水浴温度在78℃或略高于78℃,使乙醇蒸气平稳流出,提高反应效率.
(5)c处无水硫酸铜变蓝 d处生成红色沉淀
(6)
3、与氢气反应:H2+ CuO  Cu+ H2O,为保证实验安全,应先通氢气将氧气赶出后,再实验。
Cu+ H2O,为保证实验安全,应先通氢气将氧气赶出后,再实验。
例5:(2003 上海 26)实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设
计两种测定该样品(巳称得其质量为mg)中氧化铜质量分数的方法,并填写表格中的有关内容。
|
实验方法 |
实验过程中所发生反应的化学方程式 |
实验所用仪器(用编号表示) |
实验需直接测定的有关物理量(用文字说明) |
|
1 |
|
|
|
|
2 |
|
|
|
实验可能用到的主要仪器: ①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩干燥管 实验可能用到的试剂: a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
解析 本题是利用铜与氧化铜的性质差异性而设计的。方法1中实验前样品和硬质玻璃管的总质量与实验后Cu及硬质下班管的总质量之差即为氧化铜中“氧的质量”;方法2中两次质量之差即为氧化铜的质量;方法3实验后坩埚和CuO总质量与实验前坩埚与样品总质量之差即为Cu与O2反应的“增氧量”,由此都可得样品中氧化铜质量分数。
(三)与盐反应
Cu+2FeCl3=2FeCl2+ CuCl2
(二)与酸反应
1、与硝酸反应:
3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
例2:用下列仪器、药品验证由铜和适量硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。已知:
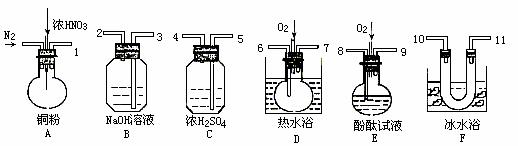
① NO+NO2+2OH-=2NO2-+H2O
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为________________________。
(2)反应前先通入N2,目的是____________________________。
(3)确认气体中含NO的现象是______________________________。
(4)装置F的作用是______________________________。
(5)如果O2过量,则装置B中发生反应的化学方程式为_____________________________。
解析:本实验的目的是验证Cu和浓HNO3反应产生的气体中的NO,即产物中一定有NO,而不是通过实验来确定是否有NO。而反应产物中NO2是一定存在的,所以要将NO2和NO分离后进行验证,如何分离?题目给出了两种气体相差甚远的液化温度,联系装置F,便知其意了。NO2和NO分离(NO2被液化)后的气体与O2作用,又出现红棕色,这个特征现象便确认了NO的存在。
另外,制气前须将各装置内的空气排尽(否则会氧化NO),气体中混有的水气的吸收以及最后尾气的吸收,这些问题都要考虑。而盛酚酞的装置E便成了命题者用来干扰思维的多余装置。
框图分析
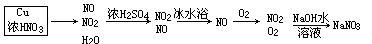
答案:(1)①⑤④(10)(11)(或(11)(10))⑥⑦③。(2)驱赶装置中的空气,防止产生的NO被氧化;(3)通入O2后装置D中有红棕色气体生成;(4)使NO2液化(分离NO2和NO);(5)4NO2+O2+4NaOH=4NaNO3+2H2O
点评:验证Cu与稀HNO3反应的产物NO,首先应保证无氧气存在,除题目中用氮气将装置中氧气赶出外,还可用下列装置检验NO:
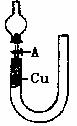
该类命题往往从气密性检验、实验现象、NO与NO2及NO2与N2O4转化、尾气吸收等方面考察。关于Cu与HNO3反应,还常以计算题形式出现,注意氮原子守衡及电子守衡的应用.
2、与浓硫酸反应:Cu +2H2SO4(浓) CuSO4+SO2+2H2O
CuSO4+SO2+2H2O
注意浓H2SO4随反应进行变稀的实验事实.
3、但当有空气或络合剂存在时,铜能溶于稀酸和浓盐酸:
2Cu+2H2SO4+O2 2CuSO4+2H2O
2CuSO4+2H2O
工业上,利用该反应原理制取硫酸铜.
2Cu+8HCl(浓) 2H3[CuCl4]+H2↑
2H3[CuCl4]+H2↑
(一)与非金属单质(O2、S、Cl2、等)反应
1、与O2反应:铜在常温下不与干燥空气中的氧化合,加热时能产生黑色的氧化铜。在潮湿的空气中放久后铜的表面会慢慢生成一层铜绿
2Cu+O2+H2O+CO2=Cu(OH)2·CuCO3
例1:自然界存在的碳酸盐类铜矿(如孔雀石、石青等)的化学组成为:aCuCO3·bCu(OH)2(a、b为正整数,且a≤2,b≤2)
(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用HCl物质的量与产生CO2物质的量之比:
孔雀石为4∶1;石青为3∶1.则它们的化学组成为:孔雀石;石青。
(2)今有一份碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产
生CO23.36L(标准状况);加热B样品使其完全分解,得到20gCuO.试计算并确定该矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶液解后,产生CO26.72L(标准状况),这份矿样中CuO含量不
低于_______.
(4)设某碳酸盐类铜矿样的质量为Ag,所含CuO质量为Gg.加酸完全溶解后,产生的CO2体积(标
准状况)为VL,则含铜矿样的A、V、G之间的关系式为:A=_______。
解答:(1)孔雀石CuCO3·Cu(OH)2石青2CuCO3·Cu(OH)2
(2)化学组成:CuCO3·Cu(OH)2与2CuCO3·Cu(OH)2混合物
(3)36g
(4)A=124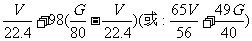
2、与硫反应:2Cu+S Cu2S ,操作要点:一束光亮的铜丝伸入到硫蒸汽中,实验现象:铜丝红热状态,取出后变黑色。
Cu2S ,操作要点:一束光亮的铜丝伸入到硫蒸汽中,实验现象:铜丝红热状态,取出后变黑色。
3、与氯气反应:Cu+Cl2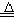 CuCl2 ,操作要点:铜丝加热伸入到低部放有少量细纱的氯气集气瓶中,实验现象:铜丝燃烧,火星四射,瓶内出现棕黄色烟,加入少量水,溶液呈黄绿色。解释:铜盐与过量Cl-离子能形成黄绿色[CuCl4]2-离子,Cu2++4Cl-===[CuCl4]2-(黄绿色)。
CuCl2 ,操作要点:铜丝加热伸入到低部放有少量细纱的氯气集气瓶中,实验现象:铜丝燃烧,火星四射,瓶内出现棕黄色烟,加入少量水,溶液呈黄绿色。解释:铜盐与过量Cl-离子能形成黄绿色[CuCl4]2-离子,Cu2++4Cl-===[CuCl4]2-(黄绿色)。
3、(1)设A与B碰撞前A的速度为 V1 ,碰撞过程动量守恒,有:
mv1=(M+m)v (2分) 代入数据解得:v1=3m/s ( 2分)
(2)对A,从开始运动至碰撞B之前,根据动能定理,有: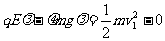 (2分)
(2分)
代入数据解得:
(3)设弹簧被压缩至最短时的压缩量为S1,对AB整体,从碰后至弹簧压缩最短过程中,根据能量守恒定律有: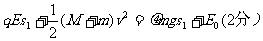 代入数据解得S1= 0.02m(1
分);设弹簧第一次恢复到原长时,AB共同动能为EK,根据能量守恒定律有:
代入数据解得S1= 0.02m(1
分);设弹簧第一次恢复到原长时,AB共同动能为EK,根据能量守恒定律有: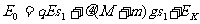 …………①(2分);在弹簧把BA往右推出的过程中,由于B受到向左的摩擦力小于A受到的向左的摩擦力和电场力之和,故至他们停止之前,两者没有分开(1分)
…………①(2分);在弹簧把BA往右推出的过程中,由于B受到向左的摩擦力小于A受到的向左的摩擦力和电场力之和,故至他们停止之前,两者没有分开(1分)
弹簧第一次将AB弹出至两者同时同处停止时,B距离竖直墙壁最远,设此时距离弹簧原长处为S2,根据动能定理,有: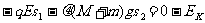 ………②(2 分)
………②(2 分)
①②联立并代入数据得S=0.03m (1分)故B离墙壁的最大距离Sm=S+S2=0.08m
2、解:(1) 由于重力忽略不计,微粒在第四象限内仅受电场力和洛伦兹力,且微粒做直线运动,速度的变化会引起洛仑兹力的变化,所以微粒必做匀速直线运动.这样,电场力和洛仑兹力大小相等,方向相反,电场E的方向与微粒运动的方向垂直,即与y轴负方向成30°角斜向下.
由力的平衡有 Eq=B1qv ∴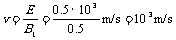
(2) 画出微粒的运动轨迹如图.
由几何关系可知粒子在第一象限内做圆周运动的半径为 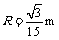
微粒做圆周运动的向心力由洛伦兹力提供,即 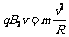 解之得
解之得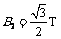
(3) 由图可知,磁场B2的最小区域应该分布在图示的矩形PACD内.由几何关系易得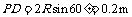
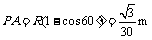 所以,所求磁场的最小面积为
所以,所求磁场的最小面积为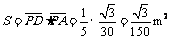
1、解:释放后A和B相对静止一起做自由落体运动,B着地前瞬间的速度为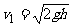
B与地面碰撞后,A继续向下做匀加速运动, B竖直向上做匀减速运动。它们加速度的大小分别为:
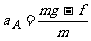 和
和 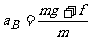
B与地面碰撞后向上运动到再次落回地面所需时间为 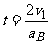
在此时间内A的位移 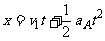
要在B再次着地前A不脱离B,木棒长度L必须满足条件 L ≥ x
联立以上各式,解得 L≥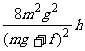
3、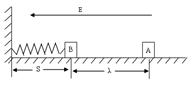 (20分)在绝缘水平面上,放一质量为m=2.0Χ10-3kg的带正电滑块A,所带电量为q=1.0Χ10-7C,在滑块A的左边处放置一个不带电、质量M=4.0Χ10-3kg的绝缘滑块B,B在左端接触(不连接)于固定在竖直墙壁的轻弹簧上,轻弹簧处于自然状态,弹簧原长S=0.05m,如图所示,在水平方向加一水平向左的匀强电场,电场强度的大小为E=4.0Χ105N/C,滑块A由静止释放后向左滑动并与滑块B发生碰撞,设碰撞时间极短,碰撞后结合在一起共同运动的速度为V=1m/s,两物体一起压缩弹簧至最短处(弹性限度内)时,弹簧的弹性势能E0=3.2Χ10-3J。设两滑块体积大小不计,与水平面间的动摩擦因数为μ=0.50,摩擦不起电,碰撞不失电,g 取10m/s2。求:
(20分)在绝缘水平面上,放一质量为m=2.0Χ10-3kg的带正电滑块A,所带电量为q=1.0Χ10-7C,在滑块A的左边处放置一个不带电、质量M=4.0Χ10-3kg的绝缘滑块B,B在左端接触(不连接)于固定在竖直墙壁的轻弹簧上,轻弹簧处于自然状态,弹簧原长S=0.05m,如图所示,在水平方向加一水平向左的匀强电场,电场强度的大小为E=4.0Χ105N/C,滑块A由静止释放后向左滑动并与滑块B发生碰撞,设碰撞时间极短,碰撞后结合在一起共同运动的速度为V=1m/s,两物体一起压缩弹簧至最短处(弹性限度内)时,弹簧的弹性势能E0=3.2Χ10-3J。设两滑块体积大小不计,与水平面间的动摩擦因数为μ=0.50,摩擦不起电,碰撞不失电,g 取10m/s2。求:
①两滑块在碰撞前的瞬时,滑块A的速度;
②滑块A起始运动位置与滑块B的距离λ;
③B滑块被弹簧弹开后距竖起墙的最大距离Sm
2010届计算题拿分训练(5)答案
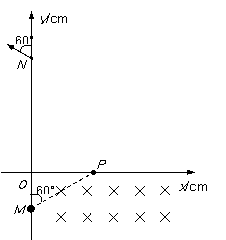
2、(18分)如图所示,第四象限内有互相正交的匀强电场E与匀强磁场B1, E的大小为0.5×103V/m, B1大小为0.5T;第一象限的某个矩形区域内,有方向垂直纸面向里的匀强磁场B2,磁场的下边界与x轴重合.一质量m=1×10-14kg、电荷量q=1×10-10C的带正电微粒以某一速度v沿与y轴正方向60°角从M点沿直线运动,经P点即进入处于第一象限内的磁场B2区域.一段时间后,小球经过y轴上的N点并与y轴正方向成60°角的方向飞出。M点的坐标为(0,-10),N点的坐标为(0,30),不计粒子重力, g取10m/s2.
(1)请分析判断匀强电场E1的方向并求出微粒的运动速度v;
(2)匀强磁场B2的大小为多大?;
(3) B2磁场区域的最小面积为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com