
27.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:
甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu。
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu。
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲 乙(填“大于”、“小于”或“等于”),原因是
。
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善。你 (填“是”或“否”)赞同丙同学的看法。
理由①(对甲同学实验而言) ,
②(对乙同学实验而言) 。
(3)请你分别对甲、乙两同学的实验加以完善:
① ;② 。
26.某化学兴趣小组通过实验对一种铜矿样品的组成进行测定。
铜矿的组成可表示为:x Cu(OH)2·y CuCO3·zH2O (x、y、z为最简整数比值);
该小组通过加热的方法,进行了定量的实验分析,得出了铜矿的组成。
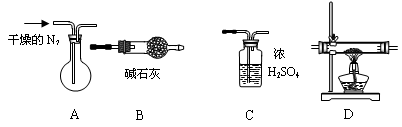 下面是实验中的一些问题,请你帮助解决有关的问题:
下面是实验中的一些问题,请你帮助解决有关的问题:

(1)用图中的仪器(有些仪器可重复使用,有些用品在图中略去)组装成实验装置,按气体流动方向从左到右连接的顺序为:A → → → → ;其中的B、C装置能否颠倒 (填:“能”或“不能”)原因是:______________________________________________________________________
(2)装置A的作用是 ;
(3)连接好装置,必须先
(4)若36.4g铜矿样品完全分解后,B装置增重了8.8g ,D装置的玻璃管减轻了12.4g ,则该铜矿组成的化学式可表示为: ;
(5)若取一定量的玻璃管中所得固体粉末和一定量的炭粉混合加热,使之充分反应后,测得固体比原混合物的质量减少了Cg ,又测得剩余固体全部为铜。则混合粉末中炭粉质量的取值范围是 。
25.“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该反应的平衡常数表达式K= 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的
实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0-44.0s
C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
24.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产
物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体
③ 分子晶体 ④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________, 用一个离子方程式加以证明 。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
23.亚硫酸钠和碘酸钾在酸性溶液中发生以下发应:
 __Na2SO3+__KIO3+__H2SO4 __Na2SO4
+_ K2SO4+ _I2 + _H2O
__Na2SO3+__KIO3+__H2SO4 __Na2SO4
+_ K2SO4+ _I2 + _H2O
(1)配平上面的方程式,在横线上填入系数
(2)其中氧化剂是__ ___,若反应中有2.5mol电子转移,则生成的碘是____mol.;氧化产物为____mol.
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
 ① IO3-
+SO32 -
IO2- + SO42 - (反应速率慢)
① IO3-
+SO32 -
IO2- + SO42 - (反应速率慢)
 ② IO2- + 2SO32
- I- + 2SO42
- (反应速率快)
② IO2- + 2SO32
- I- + 2SO42
- (反应速率快)
 ③ 5I- +6H+ +IO3- 3I2 +3H2O (反应速率快)
③ 5I- +6H+ +IO3- 3I2 +3H2O (反应速率快)
 ④ I2 +SO32
- +H2O I- +
SO42 -+2H+ (反应速率快)
④ I2 +SO32
- +H2O I- +
SO42 -+2H+ (反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。
22.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是 ( )
A.甲组和乙组的实验中,盐酸均是过量的
B.盐酸的物质的量浓度为1.0 mol·L―1
C.合金中镁铝的物质的量之比为1∶1 D.丙组中铝的物质的量为0.009 mol
第II卷(非选择题,共84分)
21.工业废气的氮氧化物(NO、NO2等,用通式NOx表示)是主要的大气污染物之一。为了保护环境,工业上常通入氨气与之发生反应:NOx+NH3→N2+H2O(未配平)。有关此反应,下列说法中正确的是 ( )
A.无论x何值,N2既是氧化产物又是还原产物
B.当x=1时,每生成2.5 mol N2,被氧化的气体有4 mol
C.当x=2时,有1 mol气体被还原,转移的电子为4 mol
D.当x=2时,反应通式配平后H2O的化学计量数为8
20.向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是 ( )
A.溶液中c(Na+)=2c(SO42-) B.a/2 mol>沉淀的物质的量>0
C.沉淀的物质的量= a/2 mol D.原溶液中c(H2SO4) = a/2 mol/L
19.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
18.下列各实验现象能用同一原理解释的是 ( )
A.苯酚、乙烯都能使溴水褪色
B.稀硫酸中加入铜粉不反应,再加硝酸钠或硫酸铁后,铜粉溶解
C.将SO2通入氯化钡溶液至饱和,再加入足量硝酸或苛性钠溶液,都产生白色沉淀
D.葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生红色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com