
8、可逆反应∶2NO2 2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是
2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2 ②单位时间内生成n molO2 的同时,生成2n mol NO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
7、25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
6、对于常温下pH为1的硝酸溶液,下列叙述正确的是 ( )
A.该溶液lmL稀释至2mL后,pH等于2
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为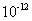 。
。
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
5、化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-→4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2Cl- → Cl2 ↑+2e-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu → Cu2+ +2e-
D.钢铁发生电化学腐蚀的正极反应式:Fe→ Fe2++2e-
4、下列实验能达到预期目的的是
A.煮沸的1 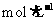 NaOH溶液中滴加FeCl
NaOH溶液中滴加FeCl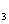 饱和溶液制备Fe(OH)
饱和溶液制备Fe(OH)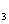 胶体
胶体
B.用石墨作电极,电解Mg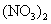 、Cu
、Cu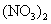 的混合溶液,确定铜和镁的金属活动性强弱
的混合溶液,确定铜和镁的金属活动性强弱
C.称取19.0g SnCl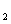 ,用100mL蒸馏水溶解,配制1.0
,用100mL蒸馏水溶解,配制1.0 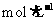 SnCl
SnCl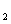 溶液
溶液
D.测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱
3、下列说法正确的是
A.两难溶电解质作比较时,Ksp小的,溶解度一定小;
B. Ksp的大小取决于难溶电解质的量,所以离子浓度改变时,沉淀平衡会发生移动;
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净;
D. 温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
2、下列有关物质保存的说法正确的组合是
①钠应该密封在煤油中保存;②过氧化钠可以露置在空气中保存;③氯水应该密封在无色试剂瓶中保存;④漂白粉不能露置在空气中保存。
A.①③ B.①②③④ C.①③④ D.①④
1、下列说法中,不正确的是( )
A.21世纪,化学科学还将继续推动材料科学的发展,使各种新型功能材料的生产成为可能
B.化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器
C.放射性元素的发现和现代量子化学理论的建立,都是进入20世纪后现代化学的重大成就
D.化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中
25.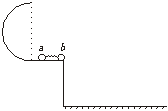 (10分)如图示,光滑水平台面上有一光滑半圆轨道,底部与水平面相切,平台与地面相距h=0.8m,在平台上两小球质量分别为ma=0.1kg,mb=0.4kg,压缩弹簧并锁定,处于静止,当解除锁定,小球b水平抛出,落地点与抛出点的水平距离为S=0.4m,小球a恰能运动到半圆轨道的最高点,(g取10m/s2)
(10分)如图示,光滑水平台面上有一光滑半圆轨道,底部与水平面相切,平台与地面相距h=0.8m,在平台上两小球质量分别为ma=0.1kg,mb=0.4kg,压缩弹簧并锁定,处于静止,当解除锁定,小球b水平抛出,落地点与抛出点的水平距离为S=0.4m,小球a恰能运动到半圆轨道的最高点,(g取10m/s2)
求:1)弹簧贮存的弹性势能;
2)原轨道半径大小。
 绵阳中学高中2011级第三次月考
绵阳中学高中2011级第三次月考
24、 (10分)如图,两平行金属板A、B水平放置,两板间的距离d=40cm。电源电动势E=24V,内电阻r=1Ω,电阻R1=15Ω,闭合开关S,待电路稳定后,将一带正电的小球从B板小孔处以初速度v0=4m/s竖直向上射入板间。若小球带电量q=1×10-2C,质量m=2×10-2kg,不考虑空气阻力,那么,滑动变阻器接R2入电路的阻值为多大时,小球恰好能达到A板?此时,电源的输出功率是多大?(g=10m/s2)w.w.^w.k.s.5*
(10分)如图,两平行金属板A、B水平放置,两板间的距离d=40cm。电源电动势E=24V,内电阻r=1Ω,电阻R1=15Ω,闭合开关S,待电路稳定后,将一带正电的小球从B板小孔处以初速度v0=4m/s竖直向上射入板间。若小球带电量q=1×10-2C,质量m=2×10-2kg,不考虑空气阻力,那么,滑动变阻器接R2入电路的阻值为多大时,小球恰好能达到A板?此时,电源的输出功率是多大?(g=10m/s2)w.w.^w.k.s.5*
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com