
18、(1)(2分)下图为常见仪器的部分结构(有的仪器被放大)
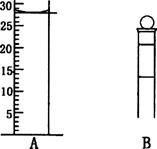


A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____ (填字母标号)。
(2)(9分)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为: 5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70-80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三: 。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验 (“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。

③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________ ,最后又变慢的原因是 。
④请写出步骤三的操作内容 。
⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为 mol·L-1。
17、⑴(2分)298K、100kPa时,C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5kJ·mol-1 2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
ΔH3=-2599 kJ·mol-1 , 请写出298K时由C(s,石墨)和H2(g)生成1molC2H2(g)的热化学方程式
(2)(3分)水是生命之源,也是化学反应中的主角。试回答下列问题: A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:
;
;
。
(3)(2分)写出硫化钠在水溶液中水解的离子方程式 在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
(4)(4分)明矾可做净水剂是因为 ,有关的离子方程式为 ;向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是 ,有关的离子方程式 。
(5)(2分)下列哪些事实能说明醋酸是弱酸
①醋酸不易腐蚀衣服
②0.1mol/L的CH3COONa溶液的PH约为9.
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多。
④0.1mol/L的CH3COOH溶液PH约为2.9。
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多。
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量。
16、下列离子方程式书写正确的是
A.在FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.向CaCl2溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3+2H+
C.向氨水中加入稀硫酸:H++OH-=H2O
D.醋酸与锌粒反应:2H++Zn2+=H2↑+Zn
第Ⅱ卷(非选择题,共52分)
15、 “神舟六号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2 +O2 =2H2O,负极反应为H2 +CO32- -→ CO2 ↑+H2O+2e-,则下列推断正确的是
A.电池工作时,CO32-向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4 OH-→O2 ↑+2H2O+2e-
D.通氧气的电极为阳极,发生氧化反应
14、常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-13mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
c(H+)+c(Na+)=c(OH-)+c(A-)
13、在一无色未知液中已检出有Al3+存在,在此溶液中能大量共存的离子组是
A.Na+、NH4+、NO3-、Cl- B.K+、Na+、HCO3-、Br-
C.Na+、H+、NO3-、S2- D. K+、Fe3+、NO3-、Cl-
12、现有下列四个图像





下列反应中全部符合上述图像的反应是( )
A.N2(g)+3H2(g) 2NH3(g);△H<0
2NH3(g);△H<0
B.2SO3(g) 2SO2(g)+O2(g);△H>0
2SO2(g)+O2(g);△H>0
C.4NH3(g)+5O2(g) 4NO+6H2O(g);△H<0
4NO+6H2O(g);△H<0
D.H2(g)+
CO(g) C(s)+H2O(g);△H>0
C(s)+H2O(g);△H>0
11、将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是 ( )
A.①⑤ B.③④ C.②⑤ D.②④
10、化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是

A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)=NH3(g);△H=(a+b)kJ·mol-1
H2(g)=NH3(g);△H=(a+b)kJ·mol-1
9、 右图为电解饱和食盐水的简易装置,下列有关说法正确的是
右图为电解饱和食盐水的简易装置,下列有关说法正确的是
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com