
21.(6分)Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2∶1反应形成盐丙。
(1)甲的电子式是 。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是 。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是 。
20.(4分)能源是国民经济发展的重要基础,我国目前使用的能 源主要是化石燃料。
源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,
则CH4燃烧 的热化学方程式是 。
的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
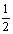 H2(g) + O2(g)
H2(g) + O2(g)  H2O(g) ΔH=-285.8 k
H2O(g) ΔH=-285.8 k J•mol-1
J•mol-1
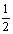 CO(g) + O2(g)
CO(g) + O2(g)  CO2(g)
ΔH=-283.0 kJ•mol-1
CO2(g)
ΔH=-283.0 kJ•mol-1
则煤的气化主要反应的热化学方程式是
C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ•mol-1。
CO(g) + H2(g) ΔH= kJ•mol-1。
19.(4分)合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH<0 具有重要的意义。
(1)该反应的化学平衡常数表达式是K= 。
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
|
T/K |
473 |
573 |
673 |
…… |
|
K |
4.4×10-2 |
K1 |
K2 |
…… |
其中,K1 K2(填“>”、“=”或“<”)。
18.为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol B.0.01 mol C.0.025 mol  D.0.03 mol
D.0.03 mol
第Ⅱ卷(非选择题 共56分)
17.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
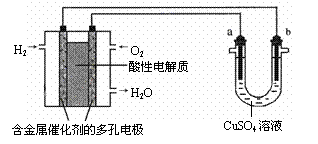
A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
16.下列叙述中 ,不正确的是
,不正确的是
A.0.1 mol•L-1 CH3COOH溶液加水稀释,n(H+)增大
B.0.2 mol•L-1盐酸与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,溶液pH为1
C.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则
c(NH4HSO4) < c(NH4NO3) < c(NH4HCO3)
15.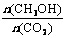 已知:CO2(g) + 3H2(g)
已知:CO2(g) + 3H2(g) 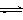 CH3OH(g)
+ H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g)
+ H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
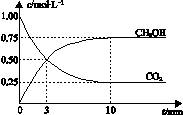 A.升高温度能使
增大
A.升高温度能使
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于
用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率
υ(H2)=0.075 mol•L-1•min-1
14.下列叙述中,正确的是
A.IA族元素,其原子半径越大金属性越弱
B.核外电子排布相同的两种微粒,化学性质一定相同
C.氨基酸具有两性,则多肽及由多肽形成的蛋白质均具有两性
D.苯分子具有不饱和性,苯与乙炔一样都可使酸性高锰酸钾溶液褪色
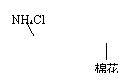
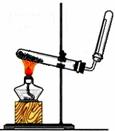
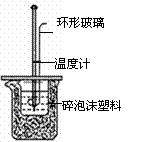
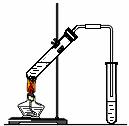
13.下图所示的实验装置 或操作不能达到实验目的的是
或操作不能达到实验目的的是
  |
 |
|
   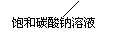 |
||
|
A.实验室 制取氨气 |
B.配制100 mL0.1 mol
/L盐酸 |
C.测定中和反应的反应热 |
D.实验室制备 乙酸乙酯 |
12.已知某强酸性溶液中存在较多的Ba2+、NO3-,则溶液中还可能大量存在的离子组是
A.K+、NH4+、HCO3- B.Fe2+、Ca2+、Cl-
C.Cu2+、Mg2+、SO42- D.Na+、Cu2+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com