
7.(长沙二校联考) 如图所示,质量为m的物体在沿斜面向上的拉力F作用下沿放在水平地面上的质量为M的粗糙斜面匀速下滑,此过程中斜面体保持静止,则地面对斜面( )
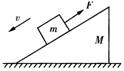 A. 无摩擦力
A. 无摩擦力
B. 水平向右的摩擦力
C. 支持力为(M+m)g
D. 支持力小于(M+m)g
(湘中八校)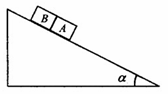 8. 如图, 一固定斜面上两个质量相同的小物块A和B紧挨着匀速下滑, A与B的接触面光滑. 已知A与斜面之间的动摩擦因数是B与斜面之间动摩擦因数的2倍, 斜面倾角为α. B与斜面之间的动摩擦因数是( )
8. 如图, 一固定斜面上两个质量相同的小物块A和B紧挨着匀速下滑, A与B的接触面光滑. 已知A与斜面之间的动摩擦因数是B与斜面之间动摩擦因数的2倍, 斜面倾角为α. B与斜面之间的动摩擦因数是( ) .
.
A、 B、
B、

C、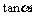 D、
D、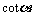

(湘中八校)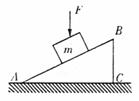 9. 如图所示,物体m恰能沿静止的斜面匀速下滑,现用一个力F
9. 如图所示,物体m恰能沿静止的斜面匀速下滑,现用一个力F .作用在物体m上,力F过物体的重心,且方向竖直向下,则不正确
.作用在物体m上,力F过物体的重心,且方向竖直向下,则不正确 .的说法是( )
.的说法是( ) .
.
A、物体对斜面的压力增大
B、斜面对物体的摩擦力增大
C、物体沿斜面加速下滑
D、物体仍能保持匀速运动
(郴州市) 10.如图所示,在光滑水平面上,用弹簧水平连接一斜面,弹簧的另一端固定在墙上,一玩具遥控小车,放在斜面上,系统静止不动。用遥控启动小车,小车沿斜面加速上升,则(
)
10.如图所示,在光滑水平面上,用弹簧水平连接一斜面,弹簧的另一端固定在墙上,一玩具遥控小车,放在斜面上,系统静止不动。用遥控启动小车,小车沿斜面加速上升,则(
)
A.系统静止时弹簧压缩
B.小车加速时弹簧伸长
C.小车加速时弹簧压缩
 D.小车加速时可将弹簧换成细绳
D.小车加速时可将弹簧换成细绳
4.(长沙一中6)如图所示,沿x轴运动的质点,以它经过原点O的时刻开始计时,其位移x(单位:m)与时间t(单位:s)关系为x=20t-5t2,则( )
A.这个质点始终做匀减速直线运动
 B.这个质点的加速度是5m/s2,加速度方向沿x轴的负方向
B.这个质点的加速度是5m/s2,加速度方向沿x轴的负方向
C.这个质点的加速度是10m/s2,加速度方向沿x轴的负方向
D.这个质点在3秒内的路程是15m
(长沙一中6) 5.如图所示,固定在地面上的粗糙绝缘斜面ABCD的倾角为θ,空间中存在着与AB边平行的水平匀强电场,场强大小为E.将一个带正电的小物块(可视为质点)放置在这个斜面上,小物块质量为m,所带电荷量为q,与斜面间的动摩擦因数为μ.若小物块静止,则下列说法中正确的是( )
5.如图所示,固定在地面上的粗糙绝缘斜面ABCD的倾角为θ,空间中存在着与AB边平行的水平匀强电场,场强大小为E.将一个带正电的小物块(可视为质点)放置在这个斜面上,小物块质量为m,所带电荷量为q,与斜面间的动摩擦因数为μ.若小物块静止,则下列说法中正确的是( )
A.小物块受到五个力的作用
B.小物块所受的摩擦力等于μmgcosθ
C.小物块所受的摩擦力等于mgsinθ
D.小物块所受的摩擦力大于Eq 
(长沙一中5) 6.船在静水中的速度与时间的关系如图(甲)所示,河水的流速与船离一侧河岸的距离的变化关系如图(乙)所示,则( )
6.船在静水中的速度与时间的关系如图(甲)所示,河水的流速与船离一侧河岸的距离的变化关系如图(乙)所示,则( )
A.船渡河的最短时间60 s
B.要使船以最短时间渡河,船在行驶过程中,船头必须始终与河岸垂直 .
.
C.船在河水中航行的轨迹一定是一条直线 .
.
D.船在河水中的最大速度一定是5 m/s .
.
3.(长郡中学)a、b两物体同时、同地、同向做匀变速直线运动,若加速度相同,初速度不同,则在运动过程中,下列说法正确的是( )
A.a、b两物体的速度之差保持不变 B.a、b两物体的速度之差与时间成正比 .
.
C.a、b两物体的位移之差保持不变 D.a、b两物体的位移之差与时间成正比
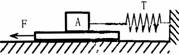 (四校联考)1.如图一个长木板放在水平地面上,在恒力F作用下,以速度V向左匀速运动,与木块A相连的水平的弹簧秤的示数为T,下列说法正确的是:( )
(四校联考)1.如图一个长木板放在水平地面上,在恒力F作用下,以速度V向左匀速运动,与木块A相连的水平的弹簧秤的示数为T,下列说法正确的是:( ) .
.
A.木板受到的滑动摩擦力的大小等于T .
.
B.木块A受到的静摩擦力的大小为T .
.
C.若用2F的力作用在木板上,木块A受到的摩擦力的大小为T .
.
D.若木板以2V的速度匀速运动时,木块受到的摩擦力大小等于2T .
.
2.(四校联考)两辆游戏赛车 、
、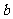 在两条平行的直车道上行驶。
在两条平行的直车道上行驶。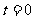 时两车都在同一计时线处,此时比赛开始。它们在四次比赛中的
时两车都在同一计时线处,此时比赛开始。它们在四次比赛中的 图如图所示。哪些图对应的比赛中,有一辆赛车追上了另一辆:( )
图如图所示。哪些图对应的比赛中,有一辆赛车追上了另一辆:( )

21.(12分)一种用于治疗高血脂的新药灭脂灵是按如下路线合成的:
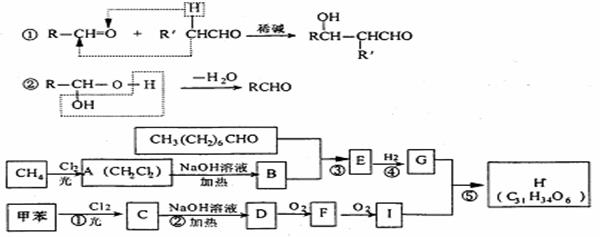
若已知G的分子式为C10H22O3,试回答下列问题:
(1) B含有的官能团的名称为_________ ;E结构简式为: ________ ;
(2) 上述反应中属于取代反应的是_______________(填序号);
(3) 写出下列反应的化学方程式:
I、反应② ;
Ⅱ、F与银氨溶液反应: 。
(4) 请写出同时符合下列三个条件的I的同分异构体 (填结构简式)。
① 遇FeCl3溶液呈紫色;
② 与新制的Cu(OH)2共热产生红色沉淀;
③ 苯环上的一氯取代物只有二种。
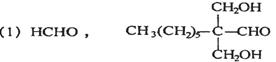

 [答案]
[答案]
 (2)①②⑤
(2)①②⑤
 (3)Ⅰ、C6H5CH2Cl+H2O
C6H5CH2OH+HCl
(3)Ⅰ、C6H5CH2Cl+H2O
C6H5CH2OH+HCl

 或C6H5CH2Cl+NaOH C6H5CH2OH+NaCl
或C6H5CH2Cl+NaOH C6H5CH2OH+NaCl

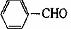 (4)HO-
。
(4)HO-
。
雅礼中学2010届高三元月质量检测
20.(10分)胃病患者常服用含碳酸氢钠的止酸剂。某研究性学习小组为测定某种止酸剂中碳酸氢钠的质量分数,设计了下列实验步骤(药片中的其他成分不与盐酸或氢氧化钠反应):
① 配制0.100mol•L–1稀盐酸和0.100mol•L–1氢氧化钠溶液;
② 取一粒药片(药片质量相同,均为0.200g),加入10.0mL蒸馏水捣碎溶解;
③ 在②所得的溶液中加入25.00 mL 0.100 mol•L–1稀盐酸;
④ 然后以酚酞作指示剂,用0.100 mol•L–1氢氧化钠溶液滴定过量的HCl,消耗氢氧化钠溶液VmL时达到终点。
请回答:
(1) 用托盘天平称出固体氢氧化钠的质量有以下步骤,其中正确操作顺序为 。
A.调整平衡螺母使天平平衡 B.将游码移至刻度尺的零刻度处
C.将固体氢氧化钠放入小烧杯中称量 D.称量空的干净小烧杯的质量
(2)下图所示的仪器中,在配制稀盐酸和稀氢氧化钠溶液时肯定不需要用的是_______________________(填仪器名称)。
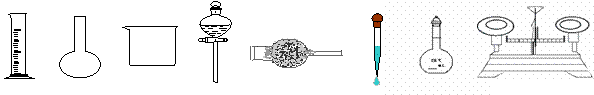
(3)若某次实验需重复测定4次。实验室现有50mL、100mL、200mL、500mL四种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格最好为200mL,理由是______________________________________________。
(4)某同学四次测定的V数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
V/mL |
9.90 |
12.80 |
10.10 |
10.00 |
请根据这位同学的实验数据,计算得出药片中碳酸氢钠的质量分数为______________。
(5)在测定过程中,下列哪些操作会使测定结果偏高? ___________
a. 步骤①配制盐酸时未将烧杯洗涤液转移至容量瓶中;
b. 步骤④滴定管用蒸馏水洗后便装液体进行滴定;
c. 步骤④滴定前,滴定管尖嘴部分有气泡,滴定后消失;
d. 步骤④滴定终点时,滴定管俯视读数。
[答案](1)B A D C; (2)园底烧瓶、分液漏斗、干燥管 (3)每次实验需加入25 mL盐酸,四次共需100 mL,但滴定管的润洗、赶气泡等操作需要用去一定量的溶液,则所配制溶液体积必须大于100 mL,故选择200 mL容量瓶。 (4)63.0% (5)a、d。
19.(10分)下图中的B-K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是
常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气
体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:

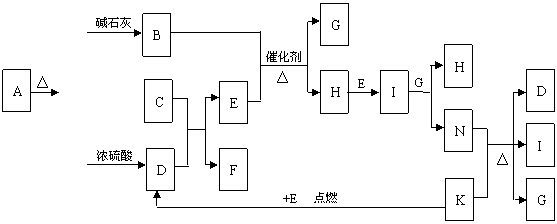

请回答下列问题:
(1) 写出实验室检验A物质中含有的阳离子的方法 。
(2) B与C反应得到1molH,则此时转移电子的物质的量为________mol。
(3) 写出实验室制取B的化学方程式 。
(4) 写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。
[答案](1) 取适量A物质放入试管中,加入适量NaOH等强碱溶液并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,则证明含有铵根离子。 (2)
5; (3) Ca(OH)2 + 2NH4Cl
 CaCl2 + 2H2O +2 NH3↑ (4) 3Fe + 8H+
+ 2NO3- == 2NO↑+3Fe2+
+ 4H2O (5) NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。
CaCl2 + 2H2O +2 NH3↑ (4) 3Fe + 8H+
+ 2NO3- == 2NO↑+3Fe2+
+ 4H2O (5) NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。
18.(12分)现有A、B、C、D、E、F六种短周期的元素,它们的原子序数依次增大,其中A与D、C与F分别为同一主族元素;A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半;A的某种同位素原子核内无中子而B的气态氢化物的水溶液遇酚酞变红。请回答下列问题:
(1)A、C两元素可形成X、Y两种化合物,其中X在MnO2作用下可以迅速分解得到Y,则X的电子式为_______________________,其分子中含有___________ 键(请用“极性”或“非极性”填空)。
(2)B、C的氢化物热稳定性顺序为(所涉及物质请用对应的分子式表示) ____________。
(3)E是一种金属元素,但也能表现出一定的非金属性,请写出单质E与氧氧化钾溶液反应的离子方程式_____________________________________________。
(4)A的单质与C的单质在KOH溶液中可以形成燃料电池,如果M和N均为惰性电极,在电池的M极通入A的单质,N极通入C的单质,则M极的电极反应式为:____________________________________。
(5)请写出D2C2与FC2反应的化学方程式_________________________________________。
 [答案](1)
; 极性和非极性;
(2) NH3<H2O; (3)2Al+2OH-+2H2O=2AlO2-+3H2↑ (4)H2―2e-+2OH- == 2 H2O (5)Na2O2
+ SO2 = Na2SO4。
[答案](1)
; 极性和非极性;
(2) NH3<H2O; (3)2Al+2OH-+2H2O=2AlO2-+3H2↑ (4)H2―2e-+2OH- == 2 H2O (5)Na2O2
+ SO2 = Na2SO4。
17.(8分)已知:氨水的电离程度与醋酸的电离程度在同条件下几乎相等。现向少量的Mg(OH)2悬浊液中,加入适量的饱和NH4Cl溶液,固体完全溶解,对此甲同学的解释是:
Mg(OH)2(s)  Mg2+(aq)+2 OH-(aq) ①
Mg2+(aq)+2 OH-(aq) ①
NH4++
H2O NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++ OH- H2O
③
H2O
③
由于NH4+水解呈酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2 OH-(aq) ①
Mg2+(aq)+2 OH-(aq) ①
NH4++
OH- NH3·H2O ②
NH3·H2O ②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合生成弱电解质NH3·H2O,导致反应①平衡右移,Mg(OH)2沉淀溶解。
⑴ 丙同学不能肯定哪位同学的解释合理,于是选取用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,你认为他选用的试剂是 (填编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
⑵ 请你说明丙同学做出该选择的理由是_____________ 。
⑶ 丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解,由此推知,甲、乙哪位同学的解释更合理? (填甲或乙)。试写出所选试剂水解的离子方程式: ______________。
[答案] ⑴ B; ⑵ 由题意可知CH3COONH4溶液可以电离出大量NH4+而且溶液本身显中性; ⑶ 乙
CH3COO-+
NH4++ H2O
 CH3COOH + NH3·H2O。
CH3COOH + NH3·H2O。
16. 现有一定量的铁粉和铜粉的混合物,将其平均分成四等份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO一种):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
根据上表中的数据计算分析,下列推断正确的是 ( )
A.①中溶解了5.6 g Fe B.②中溶解了9.6 g Cu
C.硝酸的浓度为4 mol/L D.④中V = 6720 [答案]C
第Ⅱ卷
(本卷包括5小题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com