
2.已知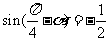 ,则
,则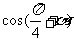 等于
等于
A.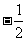 B.
B.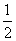 C.
C.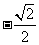 D.
D.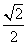
1.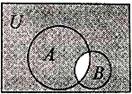 已知全集
已知全集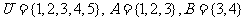 ,则图中阴影部
,则图中阴影部
分所表示的集合是
A.{3} B.{4,5}
C.{1,2,4,5} D.{1,2,3,4}
23.为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品M g;(2)加入过量盐酸;
(3)收集并测定生成的气体体积V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会_______________(填“偏高、偏低、无影响”)
[方案II](1)称取碳酸钙样品Mg;
(2)用c mol/L盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液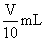 ,用
,用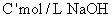 溶液滴定,恰好用去
溶液滴定,恰好用去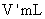 。
。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
_________________________________________________________________。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定________(填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式___________________________________。
[方案III](1)称取碳酸钙样品M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为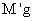 。
。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?______________________;
问题2:本方案中的“冷却”应如何操作_________________________。
[方案IV](1)称取碳酸钙样品M g;
(2)加入足量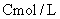 盐酸
盐酸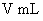 使之完全溶解;
使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量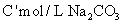 溶液
溶液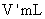 ;
;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为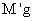 。
。
问题1:此方案中不需要的数据是_______________(填选项编号)。
A.C、V B.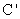 、
、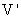 C.
C. D.M
D.M
问题2:为减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液体积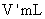
B.精确配制浓度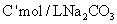 溶液
溶液
C.将步骤(3)所得沉淀洗涤,洗涤液应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量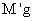 备用
备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将_________
_____(偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是__________,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案_________;_________________________________________________。
方案_________;_________________________________________________。

22.工业上储存氯气有两种方法,一是将氯气液化,贮存于钢瓶中;二是用强碱将Cl2吸收,制成固体长期保存,需用Cl2时,加入H2SO4可使Cl2释放出来。
(1)请写出用NaOH吸收Cl2的离子方程式:__________________________________;
(2)请写出释放Cl2的离子方程式:__________________________________________;
(3)请写出实验室制Cl2的化学方程式:_____________________________________。
其中浓盐酸表现了什么性质:_______________________________;
简述如何检验Cl2是否已收集满(用化学方程式):______________________________。
21.某反应中反应物与生成物有: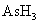 、
、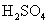 、
、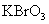 、
、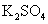 、
、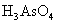 、
、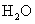 和一种未知物X
和一种未知物X
(1)若KBrO3在反应中得到电子,则该反应的还原剂是_________________
(2)已知0.2mol KBrO3在反应中得到1mol 电子生成X,则X得化学式是________。
(3)根据上述反应可推知
A.氧化性 B.还原性
B.还原性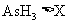
C.氧化性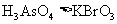 D.还原性
D.还原性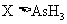
(4)写出上述氧化还原反应方程式并配平______________________________________
20.为了在实验室制取干燥的氨气,甲乙丙三位同学分别设计了如图所示三套实验装置。
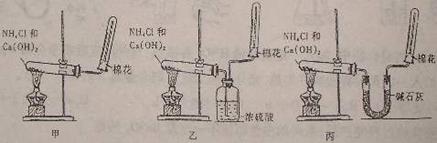
(1)上述装置中,其中________套装置肯定收集不到氨气,原因是(用化学方程式表示)
_________________________________________________________________________。
(2)为了检验NH3的某种性质,某同学将盛满NH3的试管移入水槽的水中,放开拇指,观察到的现象是
_________________________________________________________________________。
再用拇指堵住试管口取出试管,将试管内的溶液一分为三:
①一分加入酚酞,然后加热该溶液,过程中观察到的现象是______________________
__________________________________________________________________________
原因是____________________________________________________________________
②一份加入MgCl2溶液,其现象是___________________________________________,
反应的离子方程式为________________________________________________________
③一份加入盐酸溶液,反应的化学方程式为____________________________________
19.某无色澄清溶液中,可能含有较大量的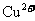 、
、 、
、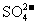 、
、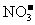 、
、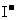 、
、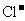 、
、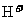 、
、 等离子中的两种或多种,为确定其组成,现做如下实验:①取适量溶液加入少量
等离子中的两种或多种,为确定其组成,现做如下实验:①取适量溶液加入少量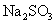 后有气体产生,也有白色沉淀生成,再加盐酸沉淀不小时,过滤。②在①的滤液中加入
后有气体产生,也有白色沉淀生成,再加盐酸沉淀不小时,过滤。②在①的滤液中加入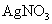 溶液,又有白色沉淀生成,再加硝酸沉淀不消失。回答下列问题:
溶液,又有白色沉淀生成,再加硝酸沉淀不消失。回答下列问题:
(1)在第①步反应中生成无色易溶于水的气体是____________________________;
在第②步反应中生成的白色沉淀是___________________________;
(2)由以上实验,可判断原溶液中一定含有的离子是_________________________;
一定不含有的离子是________________________________________。
(3)设计一个简单实验,对可能含有的离子进一步确认。
_________________________________________________________________________
_________________________________________________________________________
________________________________________________________________________。
18.在下列实验过程完成后,最终的白色沉淀不一定是BaSO4的是
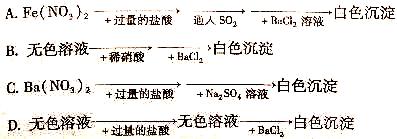
第II卷(非选择题 共46分)
17.在Fe、Cu的混合物中,加入一定量的稀HNO3并微热,充分反应后剩余金属a g。再向其中加入一定量的稀盐酸并加热,充分反应后还有剩余金属b g,则
A.a可能等于b B.a一定等于b C.a可能大于b D.a一定大于b
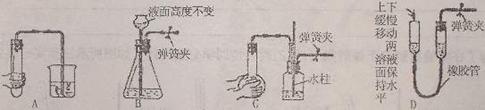
16.下列各图所示装置,肯定不符合气密性要求的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com