
22.(10分)[化学一物质结构与性质]
A、B、C、D四种元素处于同一周期,在同族元素中,A的气态氢化物的沸点最
高,B的最高价氧化物对应水化物的酸性在同周期中最强,c的电负性介于A、B之间,
D与B相邻。
(1 )C原子的价电子排布式为________________________________________
(2) A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)_____。
(3) B的单质分子中存在 个π键;D的气态氢化物DH3。分子中的中心原
子轨道采用______杂化。B和D形成一种超硬、耐磨、耐高温的新型化合物,该化合
物属于_____________________晶体,其硬度比金刚石______________(填“大”或“小”)。
(4) A的气态氢化物的沸点在同族中最高的原因是_____________________________
21.(8分)有①-----⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下图:

 已知②形成化合物种类最多,则 ② 、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_________________________________(用化学式表示)。
已知②形成化合物种类最多,则 ② 、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_________________________________(用化学式表示)。
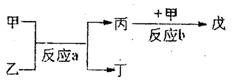
(2)若甲、乙、丙、丁、戊均为上述①---⑧八种短周期元素
中的某些元索组成的单质或由其中两种元素组成的化
合物,且甲、戊为无色气体,反应a为置换反应,反
应b为化合反应。见上图示转化关系。推测:
戊可能为:__________________、___________________(列举合适的两例)。
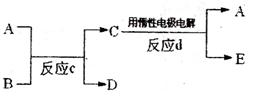 (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属
单质,反应C为置换反应类型。若反应c是用A
作电极,在B的水溶液中进行电解反应,它们有
如右图示转化关系。则反应d中阴极的电极反应
式为:
________________________________________
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式为: 。
20. (10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子方程式 。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 .
19.(10分)铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移
mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移
mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为_______________。从腐蚀废液回收得到金属铜还需要的试剂_____________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4) 钢铁的析氢腐蚀简单示意图如右。该图某处 稍
钢铁的析氢腐蚀简单示意图如右。该图某处 稍
作修 改即可成为钢铁电化学防护的简单示意
图,请直接在图中作出修改并标出电子流动方
向。
18. (8分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤。
(8分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤。
 (1)某温度下,SO2(g)+
(1)某温度下,SO2(g)+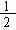 O2(g)
O2(g)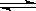 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)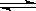 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
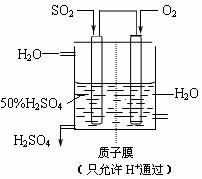
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。
(4)若通入SO2的速率为2.24 L••min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维
持不变,则左侧水的流入速率应为 mL••min-1。
17.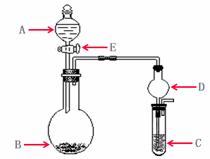
 (14分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如右图所示)
(14分)下列几个实验可快速制取实验所需的少量气体,并进行相关性质实验。(实验装置如右图所示)
 (1)若A中为
(1)若A中为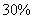 的H
的H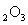 溶液,B中固体为
溶液,B中固体为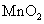 ,C中盛有
,C中盛有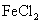 和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是_________________________。
和KSCN的混合液,旋开E后,C中的现象是变红色,C中发生氧化还原反应的离子方程式是_________________________。
 (2)若A中浓盐酸,B中装有固体
(2)若A中浓盐酸,B中装有固体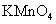 ,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1 mol KM
,C中盛有KI淀粉溶液,旋开E后,B中出现哈绿色气体。已知1 mol KM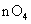 发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是________________,C中的现象是_______________________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中_______________。
发生反应时转移5mol电子,且生成的气体为单质。B中发生反应的化学方程式是________________,C中的现象是_______________________;继续反应一段时间后,发现C中溶液的颜色褪去,这是因为在溶液中_______________。
 (3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式______________________。
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,试验中观察到C出现沉淀,最后沉淀也不溶解,A中液体名称是__________C中发生反应的离子反应方程式______________________。 仪器D在此实验中的作用是___________________。
仪器D在此实验中的作用是___________________。
16. 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L
和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状
况下的气体体积为(设反应中HNO3被还原成NO)
A.0.448L B.0.672L C.0.896L D.0.224L
2009-2010学年上学期期末教学质量检测试题
高三化学 2010.1
第Ⅱ卷 非选择题(共60分)
15、在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol/LHCl溶液,溶液中C(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动
14.下列各组离子一定能大量共存的是
A.含有大量CO32-的澄清透明溶液中:Na+、K+、Cl-、[Al(OH)4]-
B.能与金属铝反应放出氢气的溶液中: K+、NO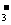 、Cl-、NH
、Cl-、NH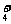
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+
D、Ph=7溶液:Mg2+、Cl-、Fe3+、SO42-
13.下列溶液中微粒的物质的量浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2 c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com