
2.三个电子各具有与磁场方向垂直的速度v、2v、3v,则它们在同一匀强磁场中回旋的半径之比和频率之比为 ( )
A.1∶2∶3,1∶2∶3 B.1∶2∶3,1∶1∶1
C.1∶1∶1,1∶2∶3 D.1∶1∶1,1∶1∶1
1.在美丽的松花江畔,位于吉林市南部24公里处,坐落着我国最早建成的大型水电站--丰满发电厂。宏伟的拦江大坝,高耸的输电铁塔,清丽的湖光山色,构成了一幅极富神韵的画卷。在丰满发电厂向长春市远距离输电中,当输送的电功率为P,输送电压为U时,输电线上损失的电功率是 ,若输送的电功率增加为4P,而输电线中损失的电功率减为
,若输送的电功率增加为4P,而输电线中损失的电功率减为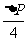 ,那么输电电压应增为 ( )
,那么输电电压应增为 ( )
A.32U B.16U C.8U D.4U
18.(16分)随着石油价格的提高,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
合成路线如下:
|
|||
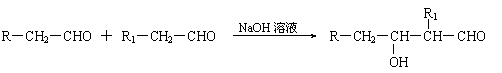 |
已知:⑴
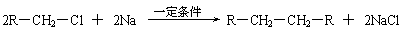
⑵
试回答下列问题:
(1)在反应①-⑦中,属于加成反应的是 ,属于消去反应的是 。
(2)写出下列反应的化学方程式
E→F H→G
(3)C的同分异构体中既能发生银镜反应又能发生水解反应的有 种。
(4)根据题给信息,写出用乙炔和苯及必要的无机试剂合成对二苯基环丁烷(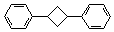 )的合成路线。
)的合成路线。
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:
17.(8分)pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC= -lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为:CO2+H2O H2CO3
H2CO3 H+ +HCO3-
H+ +HCO3- 2H++CO32-。下图为H2CO3溶液的pC-pH图。请回答下列问题:
2H++CO32-。下图为H2CO3溶液的pC-pH图。请回答下列问题:
 (1)在pH=0-4时,H2CO3溶液中主要
(1)在pH=0-4时,H2CO3溶液中主要
存在的离子为: ▲ ;
在pH=12时,H2CO3溶液中主要存在的含碳阴
离子为: ▲ ;
(2)pH<5时,溶液中H2CO3的pC值总是小于3的原因是 ▲ ;
(3)一定浓度的NaHCO3和Na2CO3混合溶
液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是 ▲
。
16.(12分)化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
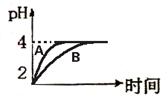 (1) 常温下,取
pH=2的盐酸和醋酸溶液各100mL, 向其中分别加 入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ▲ (
填“A”或“B”)。 设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为
m2。 则
m1 ▲ m2 ( 选填“<”、“=”、“>”)
(1) 常温下,取
pH=2的盐酸和醋酸溶液各100mL, 向其中分别加 入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ▲ (
填“A”或“B”)。 设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为
m2。 则
m1 ▲ m2 ( 选填“<”、“=”、“>”)
(2) 已知常温下Cu(OH)2 的Ksp = 2×10 -20。又知常温下某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ▲ ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为 ▲ 。
(3) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 ▲ 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) ▲ 。
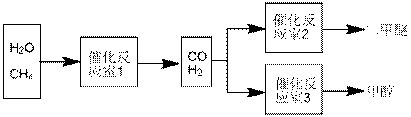
15.(12分)二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
 (1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0。
CO(g)+3H2(g)
△H>0。
在其它条件不变的情况下降低温度,逆反应速率将__▲___(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=___ ▲_____。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为____▲_______。
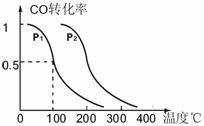
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 ▲ P2 ,正反应的△H__▲___0, (填“<”、“>”或“=").
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,
CO的转化率___▲___(填“增大”、“减小”或“不变”。下同。),平衡常数___▲_____。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数
CO(g) + 2H2(g)反应的平衡常数
为 ▲ (用含a、V的代数式表示)。
14.

 (16分)四氧化三铁在生产和生活中有着广泛的应用,人们工作中常用的打印机、复印机使用的墨粉主要成分就是Fe3O4,下图是某企业用氧化沉淀法生产Fe3O4的工艺流程:
(16分)四氧化三铁在生产和生活中有着广泛的应用,人们工作中常用的打印机、复印机使用的墨粉主要成分就是Fe3O4,下图是某企业用氧化沉淀法生产Fe3O4的工艺流程:
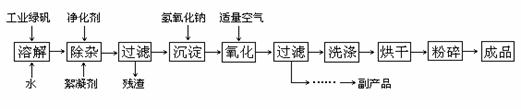
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有 ▲ ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ▲ ,检验反应后的溶液中含Fe3+的方法 ▲ ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ▲ ;
(4)流程图中所示的副产品是 ▲ ,提取该副产品还需要的的操作依次是 ▲ (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 ▲ m3/h(假设反应在标准状态下进行,空气中O2占20%)。
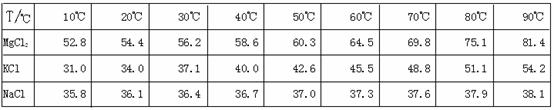
13. (14分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
(14分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
 为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:





 并设计出下面的实验流程:
并设计出下面的实验流程:

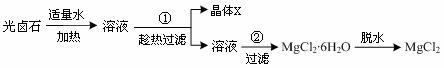




 根据他们提供的数据和实验回答下列问题:
根据他们提供的数据和实验回答下列问题:
 问题1:以上实验流程中晶体X的化学式为 ▲
,若制得的X还含有少量的可溶性杂质,可用 ▲
的方法进一步提纯。操作步骤①中趁热过滤的原因是
▲ 。
问题1:以上实验流程中晶体X的化学式为 ▲
,若制得的X还含有少量的可溶性杂质,可用 ▲
的方法进一步提纯。操作步骤①中趁热过滤的原因是
▲ 。
 问题2:工业上采用电解无水氯化镁的方法制取金属镁。
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
 (1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式: ▲ 。
▲ 。
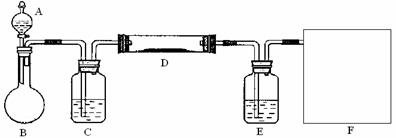
 (2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 ▲
(填写仪器的符号),需要加热的仪器是 ▲ (同上)。
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 ▲
(填写仪器的符号),需要加热的仪器是 ▲ (同上)。
 (3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。


12.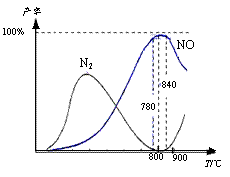 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在
780-840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,
主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g)
△H=+181.5 kJ·mol-1
2NO(g)
△H=+181.5 kJ·mol-1
非选择题(共78分)
11.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g);△H<0。
N2O4(g);△H<0。
现将一定量NO2和 N2O4的混合气体通入容积为1 L的恒温密闭容器中,
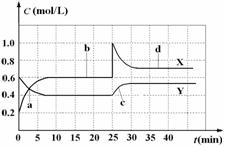 反应物和生成物浓度随时间的变化关系如右图所示。
反应物和生成物浓度随时间的变化关系如右图所示。
下列有关说法中错误的是
A.图中共有两条曲线X和Y,其中曲线X表
示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于
平衡状态的点是b和d
C.若要达到与d相同的状态,在25 min时
还能采取的措施是适当缩小容器体积
D.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com