
18.(14分)在实验室用下列装置(固定、加热仪器和橡胶管略)进行有关气体的制取实验探究。请回答下列问题:




① ② ③ ④ ⑤ ⑥ ⑦
(1)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是 …………… 。
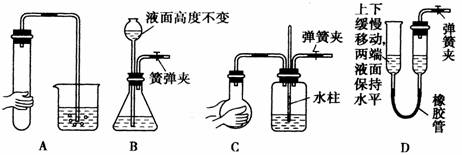
(2)若用装置③制取并收集干燥的NH ,烧瓶内装的试剂是_………___,分液漏斗中装的试剂是 …………… ,收集装置应选择___……………___(填装置序号)。证明氨气已收集满的操作是__________________………………_________________。
,烧瓶内装的试剂是_………___,分液漏斗中装的试剂是 …………… ,收集装置应选择___……………___(填装置序号)。证明氨气已收集满的操作是__________________………………_________________。
(3)将氨气通过灼热的氧化铜粉末,得到氮气和铜。要制取并收集纯净的氮气(可含有少量的水),应使用上述仪器中的(填装置序号,并按气流方向从左向右列出):③→__…………_____________。此时①中应盛放 ………… ,⑦中发生反应的化学方程式是: ……………………… 。
(4)指出下面3个实验中各存在的一个错误:

A______……………______,B____…………………______,C___…………………________
17.(11分 )有短周期元素A、B、C、D、E,已知:
① 常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜
② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
③ E与A同周期,C、D、E三种元素形成的单质或化合物可发生如下图所示的反应。
 请回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式:
……………………
;
(2)B元素在元素周期表第 …… 周期,第 ……… 族;B的固态氧化物的晶体类型是: …………… ;
(3)D元素的原子结构示意图是: ………………
;
(4)B元素与E元素的最高价氧化物的水化物的酸性强弱(用化学式表示):
…………… > …………………
;
(5)请用化学方程式表示E元素的单质在工业上的一种重要用途:
………………
。
请回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式:
……………………
;
(2)B元素在元素周期表第 …… 周期,第 ……… 族;B的固态氧化物的晶体类型是: …………… ;
(3)D元素的原子结构示意图是: ………………
;
(4)B元素与E元素的最高价氧化物的水化物的酸性强弱(用化学式表示):
…………… > …………………
;
(5)请用化学方程式表示E元素的单质在工业上的一种重要用途:
………………
。
16.(9分) 某同学按下列步骤配制500mL 0.2mol·L-1 KCl溶液,请回答有关问题。
|
实验步骤 |
有关问题 |
|
①计算所需KCl的质量 |
需要KCl的质量为(………)克(保留小数点后一位) |
|
②称量KCl固体 |
称量需要用到的主要仪器是: ……………
|
|
③将KCl加入100mL烧杯中,并加入适量水 |
为了加快溶解速率,可以采取哪些措施: ……………
|
|
④将烧杯中溶液转移至500mL容量瓶中 |
为了防止溶液溅出,应采取什么措施: ………………
|
|
⑤向容量瓶中加蒸馏水至刻度线 |
在进行此操作时当加水至刻度线1-2厘米处应如何操作: …………………………………
|
⑴上述实验中使用容量瓶前应检验 …………………… 。 ⑵在进行④步操作时未将洗涤烧杯、玻棒的洗液转移至容量瓶,则配制溶液浓度 …………… (填写偏高、偏低、不影响)。 ⑶若进行⑤步操作时加蒸馏水超过刻度线,则需 …………………… 。
15.根据下列实验内容得出的结论正确的是
|
选项 |
实 验 内 容 |
结 论 |
|
A |
某物质的水溶液使红色石蕊试纸变蓝 |
该物质一定是碱 |
|
B |
某气体能使湿润淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无味气体 |
该溶液一定含有碳酸根离子 |
|
D |
往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
第Ⅱ卷
14.下列各组仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是
A.①③⑦ B.②⑥⑦ C.①④⑧ D.④⑥⑧
13. 在离子 RO3n- 中, 共有 x 个核外电子, R 原子的质量数为 A, 则 R 原子核内含有的中子数目是
A. A–x+n+48 B. A–x+n+24 C. A–x-n–24 D. A+x-n–24
12.M元素的一个原子失去两个电子转移到N元素的两个原子中形成化合物Z,下列说法不正确的是
A.M元素的离子可表示成M2+ B. Z的化学式可表示为MN2
C.Z的熔点较高 D.Z一定不溶于水
11.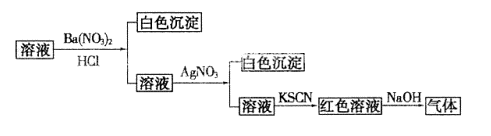 为检验某溶液中的离子,进行了如下图所示的实验操作,过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
为检验某溶液中的离子,进行了如下图所示的实验操作,过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
10.向0.50 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重4.4g,下列说法正确的是 A.增重的4.4g为反应生成的溶质的质量 B.溶质为Na2CO3 C.溶质为Na2CO3、NaHCO3 D.低温蒸干溶液,所得固体的质量为:原溶液中NaOH的质量+4.4g
9.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是 A.常温常压下,1 mol氦气含有的核外电子数为4 nA B.一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 nA C.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为nA D.标准状况下,nA个NO分子和0.5nA个O2分子混合后气体的总体积为33.6 L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com