
20.(5分) 常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl
溶液、盐酸、Na2SO4溶液中的一种。
(1)已知A、B的溶液中水的电离程度相同,A、C溶液的pH相同。A是 溶
液,B是 溶液,C是 溶液。
(2)若B溶液中c(OH-)与c溶液中的C(H+)相同,现将B的溶液稀释10倍
后溶液的pH用pHB来表示,C溶液的pH用pHC来表示,则pHB +pHC (填
>、<、或=某个数)
19.(12分) 已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-
六种离子,向试管A的溶液中滴入酚酞试液呈红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有 种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为 (填“A”或“B”)
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含
一种溶质的溶液,则加入的药品是 (填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到
一种纯净物,则混合过程中发生反应的离子方程式为 、
。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和
B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为 。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2
溶液,则发生反应的离子方程式为 。
0.1 mol·L-1 KMnO4溶液。将四支试管分成两组(每组各有一支盛有H2C2O4
溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,
分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 因素对化
学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是
。
18.(8分)已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
甲、乙两个实验小组欲探究影响化学反应速率的因
素,设计实验方案如下(实验中所用KMnO4溶液已酸
化):
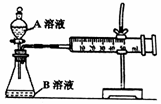
(1)甲组:通过测定单位时间内生成CO2气体体积的
量来比较化学反应速率,实验装置如图,实验时
分液漏斗中A溶液一次性加入,A、B的成分见下表:
|
序号 |
A溶液 |
B溶液 |
|
① |
2mL 0.1 mol·L-1H2C2O4溶液 |
4mL 0.01 mol·L-1KMnO4溶液 |
|
② |
2mL 0.2 mol·L-1 H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液 |
|
③ |
2mL 0.2 mol·L-1 H2C2O4溶液 |
4mL 0.01 mol·L-1 KMnO4溶液 少量MnSO4(催化剂) |
该实验探究的是 因素对化学反应速率的影响。在反应停止之前,
相同时间内针筒中所得CO2的体积由大到小的顺序是 (填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL
17.(6分)某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
(1)该反应的氧化剂是_____________。
(2)写出该反应的化学方程式:_______________________。
(3)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和
Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为_________。
16.常温时,将VlmL c1mol /L的醋酸溶液滴加到V2mL c2mol / L 的烧碱溶液中,
下列结论正确的是 A.若Vl =V2 ,且混合溶液pH <7 ,则必有c1<c2 B.若Vl =V2 ,c1=c2 ,则混合溶液中c ( OH一)=c ( CH3COOH ) + c ( H + )
C.若混合溶液的pH > 7 ,则混合溶液中c( Na + ) < c ( CH3COO- )
D.若混合溶液的pH=7 ,则混合溶液中c( Na+ ) = c (CH3COO-) +c (CH3COOH )
第Ⅱ卷 (非选择题)(共52分)
15.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物
质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
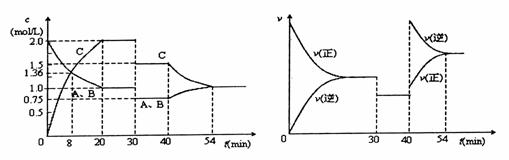
A.30min时降低温度,40min时升高温度
B.8min内A的平均反应速率为0.08mol/(L·s)
C.反应方程式中的x=1,正反应为放热反应
D.30min-40min间平衡向逆反应方向移动
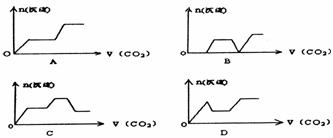
14.将足量的CO2不断通入NaOH.Ca(OH)2.NaAlO2的混合溶液中,生成沉淀与通
入CO2的量的关系可表示为:
13.向足量H2SO4溶液中加入100mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-2.92kJ·mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-0.72kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-73kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJ·mol-1
12.有机物分子中原子(或原子团)之间的相互影响会导致他们化学性质的改变。
下列叙述能说明上述观点的是
A.等物质的量的乙二醇和乙醇分别与足量金属钠反应,乙二醇产生的氢气多
B.乙烯和苯都能和氢气发生加成反应
C.乙烯可发生加成反应,而乙烷不能
D.苯酚能与氢氧化钠溶液反应,而乙醇不能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com