
14.(18分)某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)步骤②中加入盐酸的作用________________________________________________。
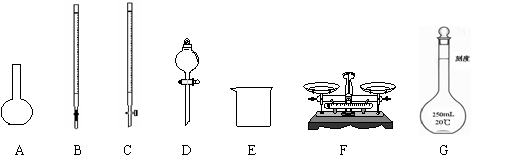
(3)写出步骤④中发生反应的离子方程式 。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3- + = __Fe3+ + ___Cl- + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(6)本实验需要称量的最少次数是 次,若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2 + 6NaOH  5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是_________________________。
13.某活动小组利用右图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。
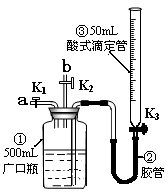 (1)向广口瓶①中通入NO并测定NO的体积
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作: ;
②从导管a通入一定量的NO,并记录滴定管液面变化的
示数为VL(V<50mL,气体体积已换算为标准状况)。
准确测定NO的体积的主要操作:
;
(2)验证NO的还原性;探究工业生产硝酸的原理
①停止通入NO后关闭K1、K3,打开K2,从导
管b缓缓通入O2,可观察到的现象是 ,
写出对应现象的化学反应方程式 、
;
②继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i 当通入氧气的体积为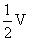 时,则广口瓶①的气体体积为
;
时,则广口瓶①的气体体积为
;
ii当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为 mol/L。
12.一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g)△H<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
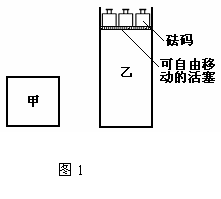

下列关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
第II卷(非选择题 ,共78分)
11. 有关下图所示化合物的说法不正确的是
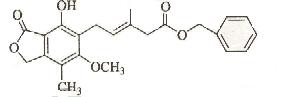
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KmnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
10. 下列说法不正确的是
A.室温下,pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7
B.某溶液中加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变混浊,原溶液中一定含有大量CO32-或SO32-
C.某试液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该溶液中一定含有SO42-
D.0.1mol/L弱酸HA溶液与 0.05mol/LNaOH溶液等体积混合后,所得溶液微粒浓度是
2c(H+) + c(HA) = c(A-) + 2c(OH-)
9.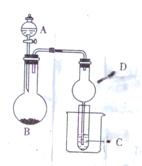 用右图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是
用右图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是
A.若A为盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛有澄清石灰水,则C中溶液出现浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.上述实验中仪器D都可以用长玻璃导管代替
8. 下列离子方程式正确的是
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液
Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-恰好完全反应
2Ba2++4OH-+Al3++2SO42-=BaSO4↓+AlO2-+2H2O
C.足量的CO2通入饱和碳酸钠溶液中
CO2+CO32-+H2O=2HCO3-
D.向Fe(NO3)2溶液中加入稀盐酸
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
7. 阿伏加德罗常数为NA,下列说法中正确的是
A.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数一定为2NA
B.14g分子式为CnH2n的烯烃中含有的C=C的数目,一定为NA/n
C.71g氯气通入足量水中,反应中转移的电子总数为NA
D.7.5gSiO2晶体中含有的硅氧键数为0.5NA
6. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
5. 在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Al3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(NH4+)=0.1mol/L的溶液:K+、Ba2+、Cl-、NO3-
D.溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com