
19.(10分)某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。
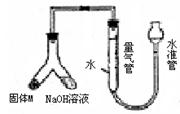 (1)如何检验该装置的气密性
(1)如何检验该装置的气密性
。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式 。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL.,则固体M中铝的质量(mA1)范围为 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积 VmL。(填“>”“<”“=”)
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程) (填“符合”或“不符合”)。
18.常温下,取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
A.C(Na+) - C(X-) = 9.9×10-7mol/L
B.C(Na+) = C(X-) + C(HX) = 0.2mol/L
C.C(OH-) - C(HX) = C(H+ ) = 1×10-6mol/L
D.混合溶液中由水电离出的C(OH-)小于0.2mol/LHX溶液中由水电离出的C(H+)
第Ⅱ卷(非选择题 共57分)
17.27.2g铁粉和氧化铁的混合物,放入500mL稀H2SO4中,发现固体完全溶解,并放出4.48L H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol·L-1 NaOH溶液,当溶液呈中性时,用掉NaOH溶液500mL,则原硫酸溶液的物质的量浓度为
A.4 mol·L-1 B.3 mol·L-1 C.2 mol·L-1 D.1 mol·L-1
16.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
15. 一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-
一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-
 2CO32- +6H2O,则有关说法正确的是
2CO32- +6H2O,则有关说法正确的是
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH +8 OH- - 6e- = CO32- + 6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
14.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
|
|
|
||
|
X |
|
|
|
|
Y |
Z |
|
|
|
|
|
W |
|
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
13.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.⑤⑥
12.下列说法正确的是
A.0.03mol/L HA与0.03mol/L NaA等体积混合得到的碱性溶液中,c(Na+)>c(A-)
B.酸性溶液中水的电离度一定比纯水的电离度小
C.pH相等的CH3COONa、NaOH和Na2CO3三种溶液,
c(NaOH)<c(CH3COONa)<c(Na2CO3)
D.室温下,pH=4的CH3COOH溶液和pH=10的NaOH溶液等体积混合后,pH大于7
11.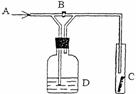 右图是一种试验某气体化学性质的实验装置,图中B为开关。若先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
右图是一种试验某气体化学性质的实验装置,图中B为开关。若先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
A.浓H2SO4 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
10.下列实验操作正确的是
A.氢氧化钠固体放在滤纸上称量
B.用如右图所示的装置可以测定黄铜(Cu、Zn合金)中 Zn的含量
C.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、Na2CO3、HCl
D.配制0.184 mol/L H2SO4时,向1000 mL容量瓶中注入10 mL 18.4 mol/L H2SO4然后边加水边震荡,最后定容
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com