
5.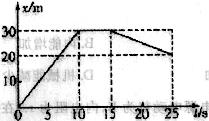 山东省兖州市2010届高三上学期模块检测一遥控玩具小车在平直路上运动的位移时间图象如图所示,则( B )
山东省兖州市2010届高三上学期模块检测一遥控玩具小车在平直路上运动的位移时间图象如图所示,则( B )
A.15s末汽车的位移为300m
B.20s末汽车的速度为一lm/s
C.前10s内汽车的加速度为
D.前25s内汽车做单方向直线运动
4.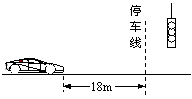 河南省武陟一中2010届高三第一次月考如图所示,以8
m/s匀速行驶的汽车即将通过路口,绿灯还有2 s将熄灭,此时汽车距离停车线18m。该车加速时最大加速度大小为2 m/s2,减速时最大加速度大小为5 m/s2。此路段允许行驶的最大速度为12.5 m/s,下列说法中正确的有:( AC )
河南省武陟一中2010届高三第一次月考如图所示,以8
m/s匀速行驶的汽车即将通过路口,绿灯还有2 s将熄灭,此时汽车距离停车线18m。该车加速时最大加速度大小为2 m/s2,减速时最大加速度大小为5 m/s2。此路段允许行驶的最大速度为12.5 m/s,下列说法中正确的有:( AC )
A.如果立即做匀加速运动,在绿灯熄灭前汽车可能通过停车线
B.如果立即做匀加速运动,在绿灯熄灭前通过停车线汽车一定超速
C.如果立即做匀减速运动,在绿灯熄灭前汽车一定不能通过停车线
D.如果距停车线5m处减速,汽车能停在停车线处
3.贵州省兴义市清华实验学校2010届高三9月月考甲、乙两物体都做匀加速直线运动,已知甲物体的加速度大于乙物体的加速度,则在某一段时间内 ( C )
A.甲的位移一定比乙的大 B.甲的平均速度一定比乙的大
C.甲的速度变化一定比乙的大 D.甲受到的合外力一定比乙的大
2.湖北省襄樊四中2010届高三摸底考试某人横渡一河流,船划行速度和水流动速度一定,此人过河最短时间为t1;若此船用最短的位移过河,则需时间为t2,若船速大于水速,则船速与水速之比为( A )
A.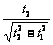 B.
B.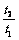 C.
C.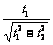 D.
D.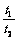
1.安徽省两地2010届高三第一次联考检测以速度v0水平抛出一小球,如果从抛出到某时刻小球的竖直分位移与水平分位移大小相等,以下判断正确的是( C )
A.此时小球的竖直分速度大小等于水平分速度大小
B.此时小球的速度大小为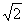 v0
v0
C.小球运动的时间为2 v0/g
D.此时小球速度的方向与位移的方向相同
24.(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为 。
② 已知1 mol·L-1 100mL B的溶液能与1 mol·L-1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
23.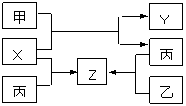 (10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子化合物,试推断:
①含有丙元素的化合物是 (填X、Y、Z)
②X与甲反应的化学方程式 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下是深红棕色液体,X、Y、Z含有同种元素形成的阳离子,但Y和Z的阳离子价态相同,X和Y的阳离子价态不同,试推断:
①写出乙、丙的化学式 。
②写出X与足量的甲在溶液中完全反应的离子方程式
。
22.(8分)在一个2L的密闭容器中,发生反应2SO3(g) 2SO2(g)+ O2(g);△H >0,其中SO3的变化如下图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如下图所示:
(1)写出该反应的平衡常数表达式 ________________ 。
(2)用O2表示0-8min内该反应的平均速率v= 。
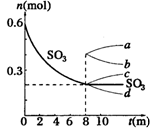 (3)升高温度,该反应的反应速率将
;K值将
;容器中气体的平均相对分子质量将 。(填“增大”“减小”或“不变”)
(3)升高温度,该反应的反应速率将
;K值将
;容器中气体的平均相对分子质量将 。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v 逆(SO2)=2v 正(O2) d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为
A.a B.b C.c D.d
21.(7分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 === 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释___________________________________________________;
(2)完成反应② ___________________________________________________。
(3)反应③中的氧化剂为______________,被氧化的元素为_______________,若有1mol K2MnF6参加反应,将会有 mol电子发生转移。
20.(10分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验:
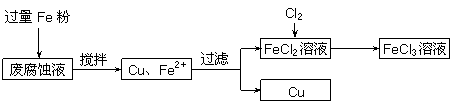

回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、 ;用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________(填化学式)。
(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2。此反应的离子方程式为___________________________________________________________。此反应中体现了盐酸的______________________________性质。利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。
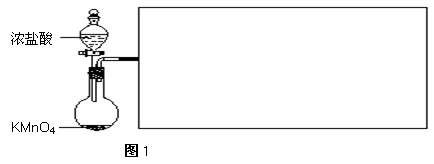
 请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。
请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。
(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,需通入Cl2的物质的量不少于_______________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com