
1.不等式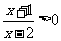 的解集是
的解集是
31.(10分)将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)
(1)生成沉淀的质量刚好最大时,反应的方程式为: 。
(2)原混合物中Ca(OH)2的质量为 g。
(3)沉淀恰好溶解时,消耗CO2的体积为 mL
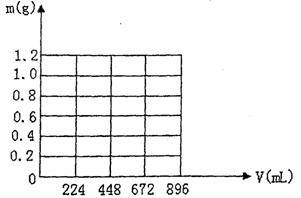
(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式。
(5)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。
30.(6分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。该实验中发生反应的化学方程式有:①2Na+2H2O→2NaOH+H2↑ ②Na2O+H2O→2NaOH ③2Al+2NaOH+2H2O→2NaAlO2+3H2↑。 试计算:
(1) 由铝生成的氢气的物质的量为_____。
(2)由金属钠生成的氢气(标准状况)的体积为_____。
(3)该钠块中n(Na):n(Na2O)为_______。
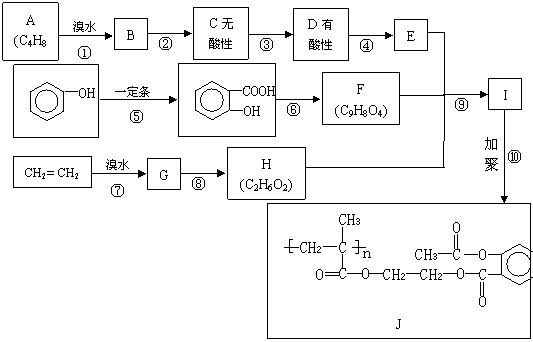
29.J是一种药物,其合成路线可以设计如下:
请完成下列各题:
(1)写出反应类型:反应③ ,反应⑥ 。
(2)写出结构简式:A ,F 。
(3)写出反应条件:反应④ ,反应⑧ 。
(4)写出反应②的化学方程式:
。
(5)E属于链状酯类的同分异构体除了:CH2=CHCOOCH3、HCOOCH=CHCH3、
CH3COOCH=CH2外,还有 , 。
(6)1mol I与足量NaOH溶液反应,消耗NaOH的物质的量最多 mol。
28.酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:
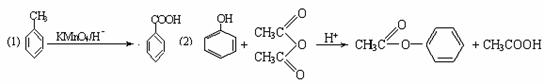
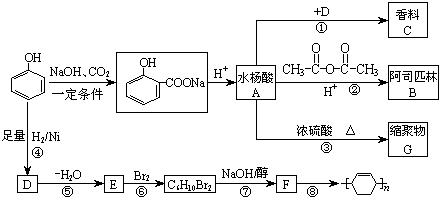
(1)写出C、G的结构简式 C ,G
(2)写出反应②的化学方程式 。
(3)写出反应⑧的化学方程式 。
(4)写出反应类型:④ ⑦ 。
27.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:
甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu。
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu。
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲 乙(填“大于”、“小于”或“等于”),原因是
。
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善。你 (填“是”或“否”)赞同丙同学的看法。
理由①(对甲同学实验而言) ,
②(对乙同学实验而言) 。
(3)请你分别对甲、乙两同学的实验加以完善:
① ;② 。
26.某化学兴趣小组通过实验对一种铜矿样品的组成进行测定。
铜矿的组成可表示为:x Cu(OH)2·y CuCO3·zH2O (x、y、z为最简整数比值);
该小组通过加热的方法,进行了定量的实验分析,得出了铜矿的组成。
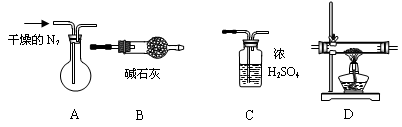 下面是实验中的一些问题,请你帮助解决有关的问题:
下面是实验中的一些问题,请你帮助解决有关的问题:

(1)用图中的仪器(有些仪器可重复使用,有些用品在图中略去)组装成实验装置,按气体流动方向从左到右连接的顺序为:A → → → → ;其中的B、C装置能否颠倒 (填:“能”或“不能”)原因是:______________________________________________________________________
(2)装置A的作用是 ;
(3)连接好装置,必须先
(4)若36.4g铜矿样品完全分解后,B装置增重了8.8g ,D装置的玻璃管减轻了12.4g ,则该铜矿组成的化学式可表示为: ;
(5)若取一定量的玻璃管中所得固体粉末和一定量的炭粉混合加热,使之充分反应后,测得固体比原混合物的质量减少了Cg ,又测得剩余固体全部为铜。则混合粉末中炭粉质量的取值范围是 。
25.“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该反应的平衡常数表达式K= 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的
实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0-44.0s
C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
24.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产
物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体
③ 分子晶体 ④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________, 用一个离子方程式加以证明 。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
23.亚硫酸钠和碘酸钾在酸性溶液中发生以下发应:
 __Na2SO3+__KIO3+__H2SO4 __Na2SO4
+_ K2SO4+ _I2 + _H2O
__Na2SO3+__KIO3+__H2SO4 __Na2SO4
+_ K2SO4+ _I2 + _H2O
(1)配平上面的方程式,在横线上填入系数
(2)其中氧化剂是__ ___,若反应中有2.5mol电子转移,则生成的碘是____mol.;氧化产物为____mol.
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
 ① IO3-
+SO32 -
IO2- + SO42 - (反应速率慢)
① IO3-
+SO32 -
IO2- + SO42 - (反应速率慢)
 ② IO2- + 2SO32
- I- + 2SO42
- (反应速率快)
② IO2- + 2SO32
- I- + 2SO42
- (反应速率快)
 ③ 5I- +6H+ +IO3- 3I2 +3H2O (反应速率快)
③ 5I- +6H+ +IO3- 3I2 +3H2O (反应速率快)
 ④ I2 +SO32
- +H2O I- +
SO42 -+2H+ (反应速率快)
④ I2 +SO32
- +H2O I- +
SO42 -+2H+ (反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com