

【板书】3:一氧化碳的化学性质
(1).可燃性
生:2C+O2 2CO, CO2十C
2CO, CO2十C 2CO
2CO
学生讨论,教师小结:(1)火炉通风不良,氧气供给不足。(2)当炉火快熄灭或刚加煤时,火炉里中下层煤炭燃烧产生的二氧化碳向上通过灼热煤炭会产生较多一氧化碳。因此,我们不宜长时间在密闭房间里使用炭火取暖。
师:有人用炉火取暖,为了防止发生煤气中毒,在火炉上放一盆水,这样做行吗?为什么?
生:不行,因为一氧化碳难溶于水。
师:有人说只要一闻到煤气味就把火炉搬出去,就不会造成煤气中毒这种说法对吗?为什么?
生:不对,因为一氧化碳没有气味。
【讲述】煤气中毒的预防措施和急救措施。
【讲述】之所以引起煤气中毒,是因为一氧化碳被人吸进肺中,跟血液里血红蛋白结合。一氧化碳跟血红蛋白的结合能力比氧气大200倍~300倍,造成机体急性缺氧。当一氧化碳在空气中浓度为0.02%时,人在2 h~3h后就会出现头晕恶心的症状;浓度达0.08%时,2h即昏迷;浓度再高,将危及生命。
【提问】用化学方程式表示生成CO的两种途径。在什么情况下容易发生一氧化碳中毒?
1.温室效应试验
实验步骤:取两只250ml的锥形瓶。一只装满制得的二氧化碳气体,另一只内是空气。用连有温度计的单孔橡皮塞塞住瓶口,把它们彼此靠近地置于实验桌上,锥形瓶底部放置一块面积大于两个锥形瓶瓶底面积的黑色的木板或纸板。在锥形瓶上方用功率为100w的反射灯泡均匀地照射,观察瓶内温度升高的情况。
温度
开始
1分钟
2分钟
3分钟
5分钟
空气
二氧化碳
实验结论:
人工降雨 1932年诺贝尔化学奖的得主、美国化学家兼物理学家兰茂尔,一生进行过有益的研究,但他在科学上实现的最大突破还是人工降雨。在获得诺贝尔奖后,他就和化学家射弗等人共同进行了人工降雨的研究。在他的研究室里保存着小小的人工云,它就是充斥在电冰箱里的水蒸气。兰茂尔一边降低冰箱里的温度,一边加入各种尘埃微粒进行降雨实验。1946年7月 的一天,天气异常炎热,由于实验装置出了故障,装有人工云的电冰箱里的温度一直降不下来,兰茂尔只好临时用固态二氧化碳(干冰)来降温。当他则把一块干冰放进冰箱里,这时奇迹出现了:水蒸气立即变成了许多小冰粒,在冰箱里盘旋飞舞,人工云化为了霏霏飘雪。这一奇特现象使他明白尘埃微粒对降雨并非绝对必要,只要将温度降到零下40度以下,水蒸汽就会变成冰而降落下来。兰茂尔高兴地去找射弗,商量怎样把这一想法付诸现实。接着便出现了振奋人心的一幕:1946年的一天,一架飞机在云海上飞行,兰茂尔和射弗将干冰撒播在云层里,30分钟后就开始了降雨。第一次真正的人工降雨获得了成功。后来,美国通用电气公司的本加特又对兰茂尔的人工降雨方法进行了改良,他用碘化银微粒取代干冰,使人工降雨更加简便易行。兰茂尔在1957年去世时,终于满意地看到人工降雨已发展成为一项大规模的事业。人工降雨的发明,标志着气象科学发展到了一个新的水平,但遗憾的是,它也曾被用于非正义的战争。如1967~1972年,美国在侵越战争中出动了2600架次飞机进行人工降雨,目的在于截断"胡志明小道"运输线,结果造成山洪暴发,交通堵塞,其破坏效果超过了常规轰炸。当然,美国政府这种滥用人工降雨的行径受到了世界舆论的谴责。
为了保护臭氧层,人类签订了以减少并逐步停止生产和使用氟氯代烷为目标的《保护臭氧层维也纳公约》、《关于消耗臭氧层物质的蒙特利尔议定书》等国际公约
氟氯代烷:氟氯代烷就是人们熟悉的“氟利昂”,氟利昂是英文“Freon”的音译。由于“Freon”是现今仍保留专利注册的外国商品名,所以“氟利昂”在教材中不宜使用。氟利昂实际是一类多卤代烃,主要是含氟和氯的烷烃衍生物,其中最常用的是一氟三氯甲烷(CCl3F,商品名叫氟利昂-11)和二氟二氯甲烷(CCl2F2,商品名叫氟利昂-12)等。因此教材中把氟利昂改称为学名――氟氯代烷。
需要注意的是,破坏臭氧层是氟氯代烷中的氯,而不是氟。氟氯代烷的化学性质很稳定,它进入大气后随气流上升,在平流层中受紫外线的照射,发生分解产生氯原子,氯原子可引发损耗臭氧的反应。
氯原子破坏臭氧层的反应为:Cl+O3=ClO+O2 ClO+O=Cl+O2 总反应为:O+O3=2O2
在反应中,Cl原子并没有消耗,而臭氧分子变成了氧气分子,Cl原子在其中起了催化剂的作用,每个Cl原子能参与大量的破坏臭氧分子的反应。因此,即使逸入平流层中的氟氯代烷不多,但由它们分解出来的Cl原子可长久地起着破坏臭氧的作用。
二:一氧化碳
【引言】碳元素有+2和+4价,所以碳的氧化物有一氧化碳和二氧化碳两种。前面我们已经学过二氧化碳的性质和制法,今天开始学习有关一氧化碳的知识。
【板书】一氧化碳
师:我们先学习一氧化碳的物理性质。
【板书】1:一氧化碳的物理性质
师:同学们一定听说过煤气中毒的事例,煤气中毒实际就是指一氧化碳中毒。它有没有颜色?有没有气味?能否溶于水?
生:没有颜色,但有气味,不清楚是否溶于水。
【展示】盛满一氧化碳气体的集气瓶。(观察气体的颜色和状态。)
生:一氧化碳是无色气体。
【演示】操作:(1)把两支分别盛满一氧化碳和二氧化碳的试管倒置在水槽中,用投影仪演示,让学生观察水面是否上升。(2)用拇指按住盛一氧化碳的试管口,从水槽中取出试管,松开手指让一位学生闻气体气味(提示用正确的操作方法闻气味),(3)按(2)同样操作从水槽中取出另一试管,滴入2滴~3滴石蕊试液。
【讲述】把两支盛满气体的试管倒置在水槽中。如果气体能溶于水,试管内的气压减小,大气压会把水压入管内,引起液面上升。如果气体不溶于水,液面不会有变化。你们通过实验得出什么结论?
生甲:一氧化碳不溶于水,无气味。二氧化碳能溶于水。
生乙:二氧化碳溶于水后,跟水反应生成碳酸,使石蕊试液变红。
师:由此说明,平时闻到的煤气味并不是一氧化碳的气味。下面请大家填写下表。
颜色
气味
状态
溶解性
密废(与空气比)
CO
CO2
H2
(气体的密度跟空气的比较可以通过比较气体的相对分子质量和空气的平均相对分子质量29得到。)
师:根据一氧化碳的物理性质,我们在实验室应怎样收集它呢?
生:排水集气法或向下排气法。
师:用向下排气法行不行?不行,因为一氧化碳无色,无法知道气体是否集满,而且一氧化碳有毒,长时间收集会使实验者中毒。
【板书】2:一氧化碳的毒性和对空气的污染
在烹饪中用发酵粉或苏打的日的是为付了产生微小的二氧化碳气泡。这些气泡使面包、糕点或发面膨胀,吃起来松软适口。在制造面包时使用酵母,其作用与此相同,只是时间长些而已。发酵粉(或碳酸氢钠)与一种酸(如从酸牛奶产生的乳酸)作用而产生二氧化碳。市售“发酵粉”中常含有固态酸,在潮湿时,它与碳酸氢钠发生作用,也产生二氧化碳。 温室效应的危害性后果是:1.冰川融化和海平面上升。事实上,冰川融化已经开始,发展下去,海面将升高,一些沿海城市将被海水淹没;2.频繁、严重的旱灾;3.更多更利害的尘暴;4.更频繁更厉害的飓风;5.更频繁更严重的森林火灾;6.野生动物濒临灭绝。
具有温室效应的气体不只是二氧化碳,还有甲烷、氟里昂等气体。
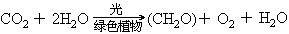 6(CH2O)→C6H12O6(葡萄糖)由葡萄糖出发,还能进一步合成脂肪、氨基酸及蛋白质等。光合作用是地球上利用太阳能最重要的过程,也是规模最大的由二氧化碳和水等无机物制造碳水化合物、蛋白质、脂肪等有机物的过程。光合作用包括光反应(光所诱发的化学反应)和暗反应(若干酶所催化的化学反应)两大部分。根据现有资料,认为光合作用大致按下列四个过程进行:
6(CH2O)→C6H12O6(葡萄糖)由葡萄糖出发,还能进一步合成脂肪、氨基酸及蛋白质等。光合作用是地球上利用太阳能最重要的过程,也是规模最大的由二氧化碳和水等无机物制造碳水化合物、蛋白质、脂肪等有机物的过程。光合作用包括光反应(光所诱发的化学反应)和暗反应(若干酶所催化的化学反应)两大部分。根据现有资料,认为光合作用大致按下列四个过程进行:
一般条件下,二氧化碳不支持燃烧且比空气重,将二氧化碳覆盖在燃着的物体表面,可使物体跟空气隔绝而停止燃烧,因此二氧化碳可用灭火,是常用的灭火剂。在化学工业上,二氧化碳是一种重要的原料,大量用于生产纯碱(Na2CO3)、小苏打(NaHCO3)、尿素[CO(NH2)2]、碳酸氢铵(NH4HCO3)、颜料铅白[Pb(OH)2?2PbCO3]等。在轻工业上,生产碳酸饮料、啤酒、汽水等都需要二氧化碳。在现代化仓库里常充入二氧化碳,防止粮食虫蛀和蔬菜腐烂,延长保存期。固态的二氧化碳即“干冰”,主要用作致冷剂,用飞机在高空喷撒“干冰”,可以使空气中水蒸气冷凝,形成人工降雨;在实验室里,“干冰”与乙醚等易挥发液体混合,可以提供-77℃C左右的低温浴。“干冰”还可以做食品速冻保鲜剂。在农业上,温室里直接施用二氧化碳作肥料,利用植物根部吸收二氧化碳,可以增进植物的光合作用。促进农作物生长,增加产量。在自然界,二氧化碳保证了绿色植物进行光合作用和海洋中浮游植物呼吸的需要。
贮藏粮食、水果、蔬菜。用二氧化碳贮藏的食品由于缺氧和二氧化碳本身的抑制作用,可有效地防止食品中细菌、霉菌、虫子生长,避免变质和有害健康的过氧化物产生,并能保鲜和维持食品原有的风味和营养成分。二氧化碳不会造成谷物中药物残留和大气污染。用二氧化碳通入大米仓库24h,能使99%的虫子死亡。
作为萃取剂。国外普遍利用二氧化碳进行食品、饮料。油料、香料、药物等加工萃取。
用二氧化碳与氢气做原料,可生产甲醇、甲烷、甲醚、聚碳酸酯等化工原料和新燃料。
作为油田注入剂。可有效地驱油和提高石油的采油率。
注入地下难于开采的煤层,使煤层气化,获得化工所需的合成气体和居间物。
保护电弧焊接,既可避免金属表而氧化,又可使焊接速度提高大约9倍。
有的科学家认为,大气中二氧化碳加倍,将使粮食平均增产超过30%,棉花增长80%以上,小麦和水稻一类作物增产36%。
二氧化碳只占空气总体积的0.3%,假如从空气中除去这些二氧化碳,自然界的生命活动还能进行下去吗?人和其他动物呼吸作用呼出的是什么气体?植物进行光合作用消耗的又是什么气体?若没有这种气体,自然界的生命活动还能进行下去吗?
几个关于二氧化碳性质的实验:
实验
现象
原因或反应式
倾倒CO2
实验6-13
烧杯底下的蜡烛先熄灭
CO2的密度比空气大。不能燃烧,也不支持燃烧。
CO2 溶解性实验
实验6-14
塑料瓶子会变形
CO2能溶于水,压强减少
CO2与水反应实验
实验6-15
紫色石蕊的花会变红,加热后又变紫色
H2O + CO2= H2CO3
H2CO3 == H2O + CO2↑
二氧化碳与水的反应比较抽象,是课题3教学难点之一。旧教材中的实验,学生往往认为是二氧化碳使石蕊变成红色。
为突破这个教学难点,这个实验设计为五步:(Ⅰ) 向干燥的紫色石蕊小花(纸花)喷稀醋酸;(Ⅱ) 向干燥的紫色石蕊小花喷水;(Ⅲ) 直接把干燥的紫色石蕊小花放入二氧化碳中;(Ⅳ) 将干燥的紫色石蕊小花喷水后放入二氧化碳中;(Ⅴ) 将(Ⅳ)中的小花取出后小心加热。(Ⅰ) 、(Ⅱ)、(Ⅲ)是独立的,是为(Ⅳ)作铺垫的,目的是使学生认识到是二氧化碳与水反应生成的碳酸使紫色石蕊变成红色,(Ⅴ) 是说明碳酸的不稳定性。通过观察实验现象,可以得出以下结论:
(1) 石蕊是一种色素,遇酸变成红色。
(2) 水不能使紫色石蕊变成红色,二氧化碳也不能使紫色石蕊变成红色。
(3) 二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊变成红色。
(4) 碳酸不稳定,容易分解成二氧化碳和水。
该实验除教材中的设计以外,还可作如下改进:
(Ⅰ) 把干燥的紫色石蕊小花放入二氧化碳中;(Ⅱ) 将(Ⅰ)中的小花喷水,观察,然后将其放入二氧化碳中;(Ⅲ) 向干燥的紫色石蕊小花(纸花)喷稀醋酸; (Ⅳ) 将(II)中的小花取出后小心加热。
二氧化碳的化学性质:
1:一般情况下,二氧化碳不能燃烧,也不支持燃烧不供给呼吸。
2:二氧化碳跟水反应生成碳酸,碳酸能使紫色石蕊试液变红色。
CO2+H2O=H2CO3(紫变红)
碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变成紫色, H2CO3==H2O+CO2↑ (红变紫) 3:二氧化碳跟石灰水反应:CO2+Ca(OH)2==CaCO3↓+H2O (清变浊)
二氧化碳的用途:二氧化碳不支持燃烧,不能燃烧,且比空气重,可用它来灭火。(简介灭火器原理),干冰升华时吸收大量热,可用它做致冷剂或用于人工降雨。工业制纯碱和尿素,植物光合作用。绿色植物吸收太阳能,同化二氧化碳和水,合成有机物质并释放出氧的过程,叫做光合作用。总反应式可表示为:
教学目标:1.通过实验分析,了解二氧化碳的物理性质,掌握二氧化碳的化学性质,根据它的性质解释一些日常生活的问题。
2:掌握一氧化碳的可燃性和还原性,并了解它的用途。
3:初步培养学生对实验装置的评价、选择和设计能力。
4:比较一氧化碳、氢气和二氧化碳性质的异同点,引导学生掌握正确的学习方法和思维方
重点:1:二氧化碳的化学性质。
2:一氧化碳的可燃性和还原性
难点:1:二氧化碳与水和石灰水反应的原理。2:一氧化碳的可燃性和还原性
教学过程:
碳的化合物种类繁多,尤其是有机化合物在国民经济的发展中起着非常重要的作用。而碳的氧化物(CO和CO2)不仅与学生的日常生活密切相关,同时也是初中化学元素化合物知识中非常重要的一部分:碳和碳的氧化物是以后学生学习许多化学反应的基础,初中化学的许多反应都与碳和碳的氧化物有关。因此,本单元课题3介绍CO2和CO的性质和用途,为学生后续阶段化学的学习打下坚实的基础。
一:二氧化碳:

制取氧气(用高锰酸钾在加热)可用A,用过氧化氢制取可用B,制CO2用C
收集方法
向上排空气法、排水法
向上排空气法
检验方法
用带火星木条伸入集气瓶中,若木条复燃该气体是氧气
将气体通入澄清石灰水中,若石灰水变浑浊说明该气体是CO2
课题3 二氧化碳和一氧化碳
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com