
18.(16分)PMMA常被用作光盘的支持基片,PMMA的单体A(C6H8O2)不溶于水,可以发生以下变化:
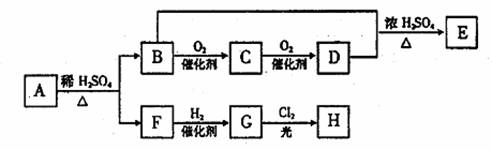 已知:E能发生银镜反应,F与NAHCO3溶液反应能产生气体,G的一氯取代产物H有两种不同的结构。请回答:
已知:E能发生银镜反应,F与NAHCO3溶液反应能产生气体,G的一氯取代产物H有两种不同的结构。请回答:
(1)F分子中含有的官能团的名称是: 。
(2)由F转化成G的反应类型属于(选填序号) 。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)由B与D反应生成E的化学方程式为 。
(4)B是一种新型汽车燃料。已知在通常情况下,1gB完全燃烧生成CO2和液态水时放热22.7kJ。则表示其燃烧热的化学方程式为 。
若利用该反应和熔融的KOH设计成一化学电源,该电源负极的电极反应式为:
。
(5)由A发生加聚反应可得PMMA,该反应的化学方程式是 。
(6)与A具有相同官能团的A的同分异构体R,不能发生银镜反应,且其在酸性条件下水解产物均能稳定存在(已知:羟基与碳碳双键连接时,不稳定),写出其可能的二种结构简式: 。
17.(16分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
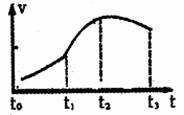 [实验一]从镁铝合金片上剪下一小块,先称重,然后投
[实验一]从镁铝合金片上剪下一小块,先称重,然后投
到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
实验浊得不同时刻气体体积如右图:
(1)t0~t0过程中速率比t1~t2速率 (“快”或“慢”),其主要原因是 。
(2)影响过程t1~t2速率的主要原因是
①
② 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①将另一种不同方法所需数据填入下表中。
|
方法 |
需测定的数据 |
||
|
① |
测定产生的H2的体积 |
||
|
② |
|
[实验二]向实验一的锥形瓶里滴加1mol·L-1HCl,使镁、
铝两种元素恰好只以氯化物的形式存在。写出此过程中
含铝元素的化合物所发生的离子反应方程式:
。
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加
a mol C1mol·L-1NaOH之后,改成滴加C2mol·L-1HCl,
所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图
所示。据此,回答下列问题:
(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则C1/C2= ;
(2)所加入NaOH溶液的体积a= mL。
13.Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在上述反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
D.2molFeSO4发生反应时,共有10mol电子转移
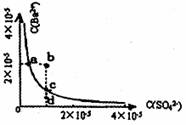 14.某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图
14.某温度时,BaSO4在水中的沉淀溶解平衡曲线如右图
所示。下列说法正确的是 ( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.a点对应的Ksp大于c点对应的Ksp
D.d点无BaSO4沉淀生成
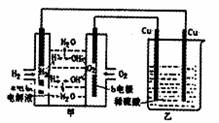 15.根据右图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是 ( )
15.根据右图所示的装置(甲中电极均为惰性电极)判断下列叙述中正确的是 ( )
A.利用该反应可持续生产硫酸铜,直至硫酸耗尽
B.甲中b电极的电极反应为:4OH-4e=2H2O+O2↑
C.通电初期乙中的总反应为:
|
Cu+H2SO4=====CuSO4+H2↑
D.反应过程中甲、乙装置的pH都逐渐减小
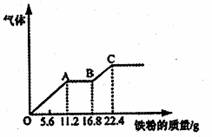 16.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两
16.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两
份。向其中一份中逐渐加入铜粉,最多能溶解19.2g
(已知硝酸只被还原为NO气体)。向另一份中逐渐
加入铁粉,产生气体的量随铁粉质量增加的变化如
下图所示。下列分析或结果错误的是 ( )
A.原混合酸中NO-3物质的量为0.2mol
B.OA段产生的是NO,AB段的反应为
Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5mol·L-1
第Ⅱ卷(52分)
12.某溶液中可能含有I-、NH+4、Cu2+、SO2-3,向溶液中加入足量的溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是 ( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO2-4 ④可能含有I-
A.①② B.①③ C.②③④ D.①②③
11.下列离子方程式正确的是 ( )
A.向Ag(NH3)2OH溶液中加足量氢溴酸:
Ag(NH3)+2+OH-+3H+=Ag++2NH+4+H2O
B.Ba(HCO3)2溶液与Ba(OH)2溶液任意比混合:
Ba2++2HCO-3+2OH-=BaCO3↓+2H2O+CO2-3
C.FeCl3溶液中撒入CaCO3粉末有气泡产生:
2Fe3++3CaCO3+3H2O=2Fe(OH)3↓+3Ca2++3CO2↑
D.向NH4HCO3溶液中加入足量NaAlO2溶液:
NH+4+AlO-2+2H2O=NH3·H2O+Al(OH)3↓
10.莽草酸是一种化合治疗禽流感药物达菲的原料,
鞣酸存在于苹果、生石榴等植物中。下列关于
这两种有机化合物的说法正确的是 ( )
A.等物质的量的两种物质跟足量的NaOH反应,
消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.鞣酸分子中,可能在同一平面上的原子最多有14个
8.下列说法正确的是 ( )
A.若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB
B.相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶质,所加水的体积前者大
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
 9.下列装置或操作能达到实验目的的是 ( )
9.下列装置或操作能达到实验目的的是 ( )
 A.a和b B.a、b、c C.b和d D.b、c、d
A.a和b B.a、b、c C.b和d D.b、c、d
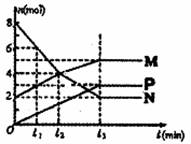
7.一定温度下测得在2L的容器中,M、N、P三种气体
物质的量的变化如图所示,则有关该反应的说法不
正确的是( )
A.该温度下的平衡常数为3.75
B.若升高温度,测得M的转化率增大,则该反应的
正反应为吸热反应
C.t3时,正反应速率大于逆反应速率
D.若测得该反应在一段时间内压强不变,说明反应达到平衡
6.某溶液中同时含有下列六种离子,①HS-、②SO2-3、③NO-3、④PO3-4、⑤SO2-4、⑥Na+向其中加入足量H2O2后,充分反应后溶液中离子浓度基本保持不变的是 ( )
 A.①②④⑤ B.②③④ C.③④⑥ D.只有⑤⑥
A.①②④⑤ B.②③④ C.③④⑥ D.只有⑤⑥
5.几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
K |
L |
M |
Q |
R |
T |
N |
|
Y原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+62 |
+2 |
2 |
+1 |
下列叙述正确的是 ( )
A.K、L、M三元素的单质的还原性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中有共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com