
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2过程中发生的化学反应方程式____________________;
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体.
Ⅰ.当通入氧气的体积为V/2时,则广口瓶①的气体体积为__________;
Ⅱ.当广口瓶①的气体体积为V/2,则通入氧气的体积可能为__________.
30.(14分)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如下图(部分反应产物已略去).
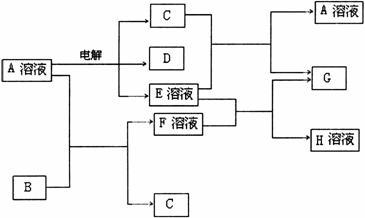
请回答下列问题:
(1)A的化学式为____________________.
(2)A溶液与Na2O2反应的总化学方程式为____________________.
(3)E的稀溶液与F溶液反应的离子方程式为____________________.
(4)电解100mL盐A的溶液一段时间后,断开电路,取出电极,测得所得到的气体D在标准状况下的体积为5.6mL,则电解后溶液的pH为__________.(假设溶液体积不变)
(5)若向100mL盐A的溶液中加入10g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16g固体C.则滤液中溶质的物质的量浓度为__________.(假设溶液体积不变)
31.(9分)为了检测饮用水中是否含有大肠杆菌,培养基的配方如下表:
|
蛋白胨 |
乳糖 |
蔗糖 |
K2HPO4 |
蒸馏水 |
|
10g |
5g |
5g |
2g |
1000mL |
(1)表中漏掉的物质是____________________,根据培养基的物理性质,该培养基应为____________________.
(2)该培养基所含的碳源有____________________,其功能是____________________.配制培养基时,必须注意各种营养物质的__________和__________.
(3)不论何种培养基,在各种成分都溶化后分装前,要进行的是____________________
(4)当大肠杆菌体内某代谢产物X含量过高时,X会与酶Y结合,导致Y的结构__________变化,Y的活性降低.人工控制微生物代谢的措施包括改变微生物的遗传特性、__________等
32.(10分)下图是人体肝细胞中三大营养物质代谢部分途径示意图,回答相关问题.箭头及其旁边的数字代表过程.
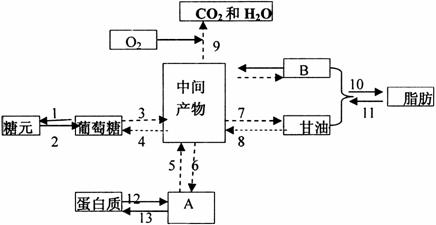
(1)图中字母代表的物质是A__________,B__________.
(2)图中能使细胞中ADP含量降低的过程是____________________(填标号).
(3)图中过程可能涉及到的细胞器除溶酶体外还有____________________.
(4)人体中糖类等其它有机物不能转化成赖氨酸,是因为____________________,由过程__________(填标号)可以得到赖氨酸,人体每天必须摄入一定量的蛋白质除与上述原因有关外还与过程__________(填三个标号)直接有关.
(5)正常人摄入商糖食物容易发胖,是因为__________分泌量增加,促进过多血糖__________,从而导致肥胖。
33.(8分)蛙的发育为变态发育,其幼体蝌蚪有尾.为了研究甲状腺激素对蝌蚪生长发育的影响,某人做了如下实验:
①将15只同种并同时孵化的蝌蚪等分成三组,分别放在3个盛有2000mL提前晾晒3天的自来水和适量金鱼藻的烧杯中,分别标号甲、乙、丙.
②向甲烧杯中加入5毫克甲状腺激素,向乙烧杯中加入2.5毫克甲状腺激素,连续投药7天,每天一次,药量相同,丙中不投药作对照.
③三组放在相同的适宜的环境中培养,每天按要求换水和喂食.
④每天测量蝌蚪身体的长度,并记录实验结果,绘制成曲线,如图.
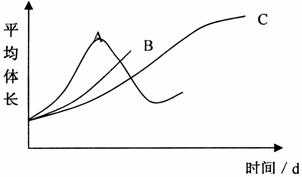
回答下列问题:
(1)请指出曲线A、C分别为哪组实验的结果
A:__________ C:__________
(2)曲线B绘制不完整,请补充完整.
(3)碘是合成甲状腺激素的原料,人类饮食缺碘导致甲状腺增生.请从激素的关系和作用角度简要解释__________________________________________________.
(4)甲状腺激素分泌过多,人的体温将升高,原因是____________________.另举一例能促进体温升高的激素__________.
34.(15分)下图表示夏季晴朗无云的某天,温室中某种C3植物二氧化碳吸收和释放速率变化曲线,请据图回答问题:
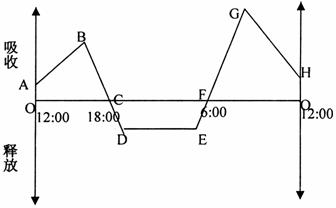
①在24小时内,植物光合作用强度和呼吸作用强度相等的是__________点所对应时刻.
②在24小时内,植物内积累有机物速度最快的是__________点所对应时刻.
③在一天内,植物积累有机物量等于__________.(用图形面积表示,如SOABC)
④一天中,叶肉细胞叶绿体中C5含量最高的是图中的__________点所对应的时刻.此时,如果采取____________________措施,既可提高光合产量,又可降低C5含量.分别于E、G两点对应的时刻,取该植物相同部位的叶片制切片,经碘液染色,观察叶肉细胞的颜色.上述操作的缺陷是____________________.经改进,实验结果是E点比G点颜色__________(深、浅)。
⑤让光照下的玉米植株处在含适宜浓度的14CO2的环境中,14C在C3、C4、C5中出现的先后顺序是__________(用箭头表示)。
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管中液面与①相平并记录滴定管的刻度.
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:______________;计算出通入的NO的体积为VmL(V<50mL).
14. 如图所示为两个波源S1和S2在水面产生的两列波叠加后的
如图所示为两个波源S1和S2在水面产生的两列波叠加后的
干涉图样,由图可推知下列说法正确的是 ( )
A.两波源振动频率一定相同
B.两波源振动频率可能不相同
C.两列水波的波长相等
D.两列水波的波长可能不相等
15.下列说法正确的是 ( )
A.悬浮在液体中的颗粒越大,撞击颗粒的液体分子数目就越多,布朗运动越明显
B.分子势能随着分子间距离的减小而增大
C.压缩一定质量的气体,气体的内能一定增加
D.对于一定量的气体,当温度不变而体积减小时,单位时间内与单位面积的器壁碰撞的分子个数一定增加
 16.如图所示为两点电荷电场的电场线分布图,由图可知( )
16.如图所示为两点电荷电场的电场线分布图,由图可知( )
A.两电荷为等量异种电荷
B.左边点电荷的电量大于右边点电荷的电量
C.左边点电荷的电量小于右边点电荷的电量
D.左边点电荷可能为负电荷
17.2005年北京时间7月4日下午1时52分,美国探测器成功撞击“坦普尔一号”彗星,投入彗星的怀抱,实现了人类历史上第一次对彗星的“大对撞”.如下图所示,假设“坦普尔一号”彗星绕太阳运行的轨道是一个椭圆,其运动周期为5.74年,则关于“坦普尔一号”彗星的下列说法正确的是 ( )
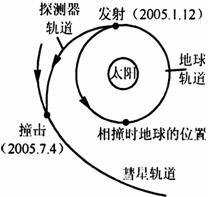
A.该彗星绕太阳运动的线速度大小不变
B.该彗星近日点处线速度小于远日点处线速度
C.该彗星近日点处加速度大小大于远日点处加速度大小
D.该彗星椭圆轨道半长轴的三次方与周期的平方之比是一个常数
18.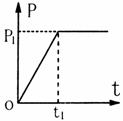 汽车发动机的额定功率为P1,它在水平路面上行驶时受到的阻力f大小恒定,汽车在水平路面上由静止开始作直线运动,最大车速为v.汽车发动机的输出功率随时间变化的图象如图所示.则 ( )
汽车发动机的额定功率为P1,它在水平路面上行驶时受到的阻力f大小恒定,汽车在水平路面上由静止开始作直线运动,最大车速为v.汽车发动机的输出功率随时间变化的图象如图所示.则 ( )
A.开始汽车做匀加速运动,t1时刻速度达到v,然后做匀速
直线运动
B.开始汽车做匀加速直线运动,t1时刻后做加速度逐渐减小
的直线运动,速度达到v后做匀速直线运动
C.开始时汽车牵引力逐渐增大,t1时刻牵引力与阻力大小相等
D.开始时汽车牵引力恒定,t1时刻牵引力与阻力大小相等
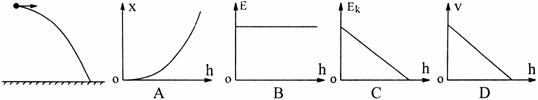
19.将物体从一定高度水平抛出(不计空气阻力),物体运动过程中离地面高度为h时,物体水平位移为x、物体的机械能为E、物体的动能为EK、物体运动的速度大小为v.以水平地面为零势能面.下列图象中,能正确反映各物理量与h的关系的是 ( )
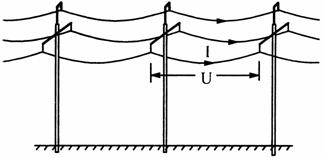
20.如图所示为平原上的三相高压输电线路示意图.每根输电杆高度相同、等距排列,相邻输电杆间三段导线长度相同.己知输电线粗细均匀,横截面积均为S,电阻率均为ρ,密度均为ρ1.若相邻输电杆间每根输电线两端电压为U、每根电线输电电流为I,不计导线电流间相互作用力.则导线对每根输电杆的总作用力大小为 ( )
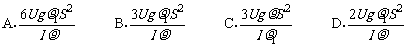
21.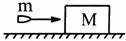 如图所示,子弹水平射入放在光滑水平地面上静止的木块,子弹未穿透木块,此过程木块动能增加了6J,那么此过程产生的内能可能为 ( )
如图所示,子弹水平射入放在光滑水平地面上静止的木块,子弹未穿透木块,此过程木块动能增加了6J,那么此过程产生的内能可能为 ( )
A.16J B.12J
C.6J D.4J
第Ⅱ卷(非选择题174分)
22.(8分)某学生骑着自行车(可视为质点)从倾角为θ=37°的斜坡AB滑下,然后在水平地面BC上滑行一段距离后停下,整个过程中该学生始终未蹬脚踏板,如图甲所示.自行车后架上固定一个装有墨水的容器,该容器距地面很近,每隔相等时间T滴下一滴墨水.该学生用最小刻度为cm的卷尺测得某次滑行数据如图乙所示.假定人与车这一整体在运动过程中所受阻力大小恒定.己知人和自行车总质量m=80kg,g取10m/s2,sin37°=0.6,cos37°=0.8.则T=__________s,人与车在斜坡AB上运动时加速度大小a1=__________m/s2,在水平地面运动时加速度大小a2=__________m/s2.

23.(10分)甲、乙两同学使用完全相同的器材用伏安法测量同一未知电阻Rx的阻值,电流表 (量程0-5mA,内阻约10Ω),电压表
(量程0-5mA,内阻约10Ω),电压表 (量程0-3V,内阻约3000Ω),最大阻值为1700Ω的滑动变阻器,电源E(电动势约为3V),开关S、导线若干.两人将其测量数据绘成U-I,图象后如图甲和图乙所示.
(量程0-3V,内阻约3000Ω),最大阻值为1700Ω的滑动变阻器,电源E(电动势约为3V),开关S、导线若干.两人将其测量数据绘成U-I,图象后如图甲和图乙所示.
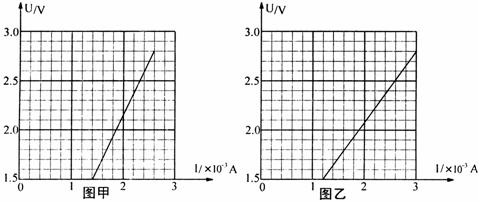
(1)由图甲得Rx=__________Ω;由图乙得Rx=__________Ω.(结果保留三位有效数字)
(2)在下面方框中分别画出甲、乙两位同学所用的测量电路,并由测量结果判定__________同学测量结果较为准确.


24.(16分)假期中,小芳乘坐火车外出旅游,当火车在一段平直轨道上匀加速行驶时,她用身边的器材测出火车的加速度.小芳的测量过程如下:她一边看着窗外每隔100m的路标,一边用手表记录着时间.她观测到她所在车厢从经过第一根路标到经过第二根路标的时间间隔为12s,从经过第一根路标到经过第三根路标的时间间隔为22s.请你根据她的测量情况,求:
(1)火车的加速度大小(保留三位有效数字)
(2)火车经过第三根路标时的速度大小(保留三位有效数字)
25.(18分)如图所示,质量为m1=50kg的某学生(可视为质点)站在长为L=3m、质量为m2=100kg的甲车右端,人和车均处于静止状态,地面水平光滑.一质量为m3=100kg的乙车以速度v0=3m/s向右运动.当该学生发现乙车时,两车距离为d=5m,该学生马上在甲车上向左匀加速跑动,跑到甲车车尾后从甲车跳到乙车上,假设该生跳到乙车后马上相对乙车静止.求:
(1)为了避免在学生从甲车跳出前两车相碰,该学生跑动时加速度a1至少为多少?
(2)要使两车不相碰,该学生跑动时加速度a2至少为多少?
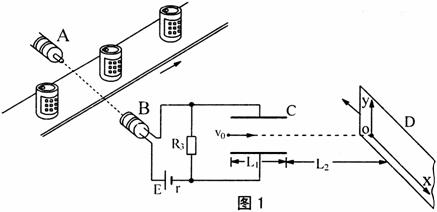
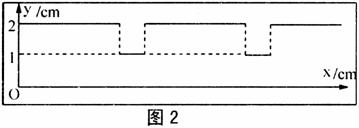
26.(20分)如图1所示,为利用光敏电阻检测传送带上物品分布从而了解生产线运行是否运行正常的仪器.其中A是发光仪器,B是一端留有小孔用绝缘材料封装的光敏电阻.当传送带上没有物品挡住由A射向B的光信号时,光敏电阻阻值为R1=50Ω;当传送带上有物品挡住由A射向B的光信号时,光敏电阻阻值为R2=150Ω.固定电阻R3=45Ω.C为平行板电容器,虚线与两极板距离相等,极板长L1=8.0×10-2m,两极板的间距d=1.0×10-2m.D为屏,与极板垂直,D到极板的距离L2=0.16m,屏上贴有用特殊材料做成的记录纸,当电子打在记录纸上时会留下黑点,工作时屏沿图示方向匀速运动.有一细电子束沿图中虚线以速度v0=8.0×106m/s连续不断地射入电容C,v0延长线与屏交点为O.图2为一段记录纸.
已知电子电量e=1.6×10-19C,电子质量m=9×10-31kg.忽略细光束的宽度、电容器的充电放电时间及电子所受的重力.求:电源的电动势E和内阻r.
27.(14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________.
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________.
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:____________________.
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是____________________.
28.(16分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
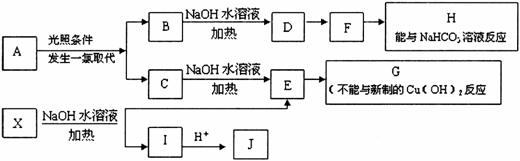
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为____________________.(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为____________________.
(3)E与H反应的化学方程式是____________________;反应类型是__________.
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是__________.
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式.
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种.________________________________________
29.(16分)某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理.
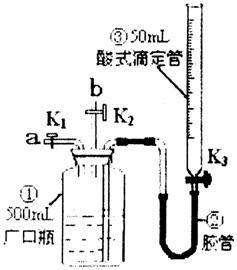
如何检查该装置气密性____________________.
13.将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示.下列有关判断不正确的是 ( )
A.AB段发生反应的的离子方程式为:
Ba2++SO42-+2H++2OH-=
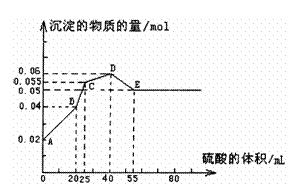 BaSO4↓+2H2O
BaSO4↓+2H2O
B.D点表示的溶液呈酸性
C.C点表示的沉淀的化学式为Al(OH)3、
BaSO4、Fe(OH)2
D.混合物中FeSO4和AlCl3的物质的量
相等
12.用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解.此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是 ( )
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8mol
D.原某浓度的NaCl溶液中溶有117g NaCl
11.北京大学教授,著名的化学家和教育家徐光宪教授,是我国理论化学和稀土化学的奠基人之一,2008年获得“国家最高科学技术奖”,以表彰他在稀土理论方面作出的贡献.稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应并产生气体.已知:铈常见的化合价为+3和+4,且Ce4++Fe2+=Ce3++Fe3+.下列说法正确的是 ( )
A.用Pt作阴极,Fe作阳极,电解熔融CeO2,可在阳极获得铈
B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中,其离子方程式为:
Ce4++Fe2+=Ce3++Fe3+
C.金属铈着火,可采用普通的泡沫灭火器灭火
D.金属铈可浸于煤油中保存,储存在阴凉、通风的地方,要远离火种和热源
10.下列叙述正确的是 ( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:
c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
9.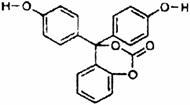 如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH关于该化合物的下
如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH关于该化合物的下
列说法中,正确的是 ( )
A.该有机物的化学式为C20H14O5,该有机物可以属于酯类、酚类、醚类
B.该有机物可以与浓溴水发生加成反应
C.与足量氢氧化钠溶液充分反应,1mol该有机物最多可以与5mol NaOH反应,所得产物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是 ( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.常温下,46g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA
C.125mL 16mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA
D.标准状况下,体积为22.4L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com