

4.我们要关爱地球上的一切生命,特别是要关爱和呵护珍稀野生动物,因为它们?( )
A.是地球的宝贝和人类的主人? B.可以保护人类免受伤害?
C.是与我们同住地球家园的朋友? D.可以变为财富供人类享用
被教育部评为“全国模范教师”的郴州市桂东县南华小学山区教师曾庆祥,28年来扎根桂东边远山区,身兼数职:校长、老师、炊事员和保育员,为山区教育事业奉献了全部的爱,被誉为孩子们的老师、保姆、父亲。据此回答第2-3题。
2.材料说明( )
A.人生的价值体现在对他人、对社会的奉献之中 B.只有作出重大贡献的人才是人才
C.人生的意义不在于奉献,而在于索取 D.成功的关键在于所处的时代和机遇
3.从曾庆祥身上我们可以看出( )
①他是一个具有高度民主社会责任感的人 ②他是一个具有无私奉献精神的人 ③老师都是有爱心和奉献精神的④他很好地扮演了自己的社会角色
A.①②③④ B.①②④ C.①③④ D.②③④
1、下列能体现珍爱生命、善待生命的行为有 ( )
①小宇买了一只小狗,养了一段时间,发现很烦就将它遗弃了 ②小亮劝阻了小涛践踏草坪 ③小芸救护了一只受伤的小鸟 ④游人向动物园里的猴子乱扔食物
A. ①② B. ②③ C. ③④ D. ①④
26、 在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应:Cu2O-2e-+2H+=2Cu2++H2O是一个半反应式,下列五种物质FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI中的一种物质A能使上述半反应顺利发生。
在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应:Cu2O-2e-+2H+=2Cu2++H2O是一个半反应式,下列五种物质FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI中的一种物质A能使上述半反应顺利发生。
(1)写出并配平该反应的离子方程式:_______________________________
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,还原产物Mn2+(无色), 反应的离子方程式为___________________________________________________;判断Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序是(用离子符号表示)___________。
(3)某同学用上述原理测定一种含Cu2O的矿石中的质量分数。称量5.0g矿石溶于 足量A和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.1000mol·L-1的高锰酸钾溶液的体积为100.00mL。
①滴定时,高锰酸钾溶液应置于_______(填如图所示的“甲”或“乙”)滴定管中,滴定终点的颜色____________________。
②该同学测得矿石样品中Cu2O的质量分数为_________________________
③下列情况使测定结果一定偏高的是_________________________
A、开始和终点都是仰视读数 B、没有用待测液润洗锥形瓶
C、称量时,砝码与样品放反了 D、样品中含有较强还原性杂质
E、高锰酸钾溶液中含有NO3- F、用酸性高锰酸钾溶液润洗滴定管
25、(12分)某有机物D仅有C、H、O三种元素组成,完全燃烧1molD恰好需要4mol氧气,金属钠不能使D放出H2,氧化剂可使D转变为化合物E,0.37gE恰好可与25mL 0.20mol/L的NaOH溶液中和。
(1)D的结构简式为_________,E的分子式为__________
已知: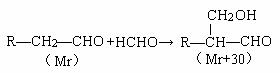
化合物D有如下转化:
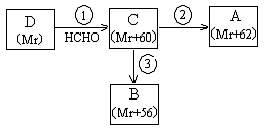
(2)写出反应③的方程式:____________________________________________
(3)写出A与足量E反应的化学方程式:_______________________________________
(4)A满足下列条件的同分异构体有_______种。①分子中不含支链②两个羟基不连在同一个碳原子上。
24、(11 分)短周期元素A、B、C、D、E,A、B同周期,C、D、E同周期,B元素最外层电子数为A元素最外层电子数的1/2,C元素带两个单位正电荷的离子排布与A原子结构相同,D在所处周期中离子半径最小,E在所处周期中原子半径最小。回答下列问题:
(1)A的元素符号为______,根据所学知识判断,元素114X与B元素是否位于同一主族_______(是或者否),其氯化物的化学式为______________。
 (2)用电子式表示CE形成化合物的过程_________________
(2)用电子式表示CE形成化合物的过程_________________
C在一定条件下置换出B的化学方程式为____________________
D元素最高价氧化物的水化物电离方程式为_______________
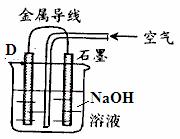
(3)已知D与石墨构成右图装置,写出D电极方程式____ ___
23、(10分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件和产物未列出。已知C、D、E、H是常见的气体且D为单质。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J的失效反应原理。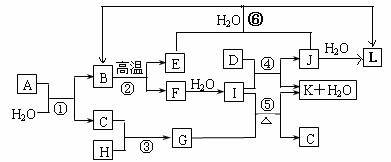
请回答下列问题:
⑴物质L的电子式为____________,E的结构式为_______________。
⑵D所含元素位于周期表__________________,生产D的工业被称为_______________。
⑶反应⑤的化学方程式为___________________________________________。
反应⑥的离子方程式为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
22、在一恒容密闭容器中发生某化学反应2A(g)  B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如下图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如下图所示:
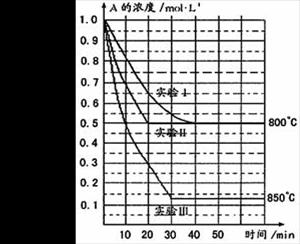
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为________mol·L-1min-1。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_____________________________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间_________实验Ⅰ(填写“大于”、“等于”或“小于”)。
21、某100 mL溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1 mol。
|
阴离子 |
SO2-4、NO-3、Cl― |
|
阳离子 |
Fe3+、Fe2+、NH+
4 、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
试回答下列问题:
(1)原溶液中所含阳离子是(写离子符号,后同) ,阴离子是 。
(2)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验中所发生反应的离子方程式是_______________________、___________。
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是 。
(4)若用惰性电极电解该溶液,当阴极开始产生气体时,阳极共收集到气体体积为________L(标准状况)
20、将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比
A.1︰1 B.1︰2 C.1︰3 D.无法确定
II卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com