
2.(1997-6)(改编)NO的生物活性已引起科学家高度重视。它能与超氧离子(O2-)1:1反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。回答如下问题:
(1)写出A的化学式。写出NO跟超氧离子的反应。
(2)A离子和水中的CO2迅速一对一地结合。试写出这种物质的化学式。
(3)含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。写出Cu+和NO2-在水溶液中的反应。
(4)在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物是N2O,写出化学方程式。并解释为什么最后的气体总压力略小于原压力的2/3。
答案: (1)ONO2-;NO+O2-=ONO2-(2)NCO5-(3)NO2–+Cu++2H+ =NO+Cu2++H2O(写2OH-可以)(4)3NO=N2O+NO2(歧化反应)
解析:(1)NO与超氧离子(O2-)1:1反应,故产物为ONO2-,不能写成NO3-,反应方程式为NO+O2-=ONO2-(2)A离子和水中的CO2迅速一对一地结合。故产物为ONO2-+ CO2= NCO5-。(3)因亚硝酸根转化为一氧化氮,Cu+和NO2-在水溶液中的反应方程式为NO2–+Cu++2H+ =NO+Cu2++H2O(写2OH-可以)。(4)根据阿伏加德罗定律,压强之比等于物质的量之比,再根据电子得失守恒,可知方程式为3NO=N2O+NO2。
链接高考(2道近年高考题)
1.(2000-12)氯化亚砜(SOCl2),一种无色液体,沸点79℃,重要有机试剂,用于将ROH转化为RCl。氯化亚砜遇水分解,需在无水条件下使用。
(1)试写出它与水完全反应的化学方程式:__________________________;
(2)设计一些简单的实验来验证你写的化学方程式是正确的。(只需给出实验原理,无须描述实验仪器和操作。评分标准:设计的合理性-简捷、可靠、可操作及表述。)
答案: (1)SOCl2+H2O=SO2+2HCl(说明:写成H2SO3也按正确答案论)
(2)向水解产物的水溶液通入硫化氢应得到硫磺沉淀。向另一份水解产物的水溶液加入硝酸银应得到白色沉淀。
解析:SO2溶于水得到和盐酸的混合溶液,亚硫酸可用硫化氢检验,盐酸可用硝酸银检验。
8.将充满NO2和O2混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量简体积的一半处停止了,则原混合气体中NO2和O2的体积比是多少?
答案:V(NO2):V(O2)= 2:3
解析:NO2和O2的体积比不等于4:1,则需讨论 NO 2和O2分别过量时的两种情况。
设混合气体的体积为1,混合气体中NO2的体积为x,则O2为(1一x)
(1)假定原混合气体中V(NO2):V(O2)<4:l
4NO2+ O2+H2O=4HNO3
4 1
x x/4
剩余的O2:(1-x)-x/4=1/2解得x=2/3,V(NO2):V(O2)= 2:3
(2)假定原混合气体中NO2和O2的体积比>4:1
4NO2 + O2 +H2 O = 4HNO3
4 1
4(1-x) 1-x
暂时剩余NO2:1-5(1-x)=5x-4
由反应式②3NO2+H2O=2HNO3+NO 可知最后余NO:(5x-4)/3,由(5x-4)/3=1/2解得z=1.1(不合题意,舍去)
竞赛篇(题型随意,共2道)
7.我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
|
测试时间/h |
0 |
1 |
2 |
3 |
4 |
|
雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答下列问题:(已知Cl2+SO2+2H2O H2SO4+2HCl)
H2SO4+2HCl)
①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变________(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在20世纪的60年代-70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。
答案:(1)①2H2SO3+O2 2H2SO4②小(2)C(3)不可取。因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害。
2H2SO4②小(2)C(3)不可取。因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害。
解析:酸雨放置时pH变化,其原因是雨水中的H2SO3被空气中氧气氧化所致。雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应。
6.(原创)关于SO2与NO2的下列说法错误的是
A.都能与NaOH溶液反应生成两种盐 B.都能使石蕊试液变红
C.都是引起光化学烟雾的大气污染物 D.工业制硫酸、硝酸时要用到它们
C解析:SO2和水反应生成H2SO3是二元中强酸,与NaOH溶液反应生成两种盐Na2SO3和NaHSO3,后者与NaOH溶液反应生成两种盐NaNO2和NaNO3,故A正确;SO2,NO2溶于水都能生成酸H2SO3,HNO3,都能使石蕊试液变红,故B正确;SO2不是引起光化学烟雾的大气污染物,故C错误;工业制硫酸时,先生产SO2,再把SO2氧化成SO3,用水吸收SO3生成H2SO4,工业制硝酸时,NH3氧化为NO、NO2,溶于水生成硝酸,故D正确。
5.(原创)将SO2和NO2混合气体通入BaCl2溶液中,其结果是( )
A.2种气体都被吸收,并有白色沉淀析出
B.生成BaSO4和BaSO32种沉淀
C.2种气体都被吸收,并有白色沉淀析出,还有无色气体从溶液中逸出,遇空气变红棕色
D.生成BaSO3沉淀,NO2从溶液中逸出
C解析:SO2通入BaCl2溶液中,SO2与水反应生成H2SO3,H2SO3与BaCl2溶液作用不产生沉淀,故B错;NO2溶于水生成硝酸,将H2SO3氧化为H2SO4,与BaCl2生成BaSO4白色沉淀,并放出NO,遇空气反应生成NO2,故C正确,AD错。
4.(原创)下列叙述错误的是( )
A、标准状况下,1molNO和1molSO2体积都为22.4L
B、NO和SO2熔沸点都较低,在常温下都是无色气体
C、SO2有毒而NO对人无害
D、SO2和NO2都是大气染物,是形成酸雨的主要物质
C D解析:NO、SO2在标准状况下是气体,故A正确;SO2、NO的沸点低,在常温下都是无色气体,故B正确;SO2、NO对人都有毒害作用,故C错。硫的氧化物是形成酸雨的主要因素,NO2不是形成酸雨的主要因素,D错。
3.为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上通过生石灰和含硫的煤混合使用可以“固硫”(避免硫化合物进入大气),最后生成石膏。整个“固硫”反应所涉及的反应类型包括:①化合②分解③置换④复分解⑤氧化还原反应⑥非氧化还原反应⑦离子反应⑧非离子反应(分子反应)。其中正确的是( )
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
C解析: 在含硫的煤中加生石灰“固硫”的反应是CaO+ SO2= CaSO3、2CaSO3+O2= 2CaSO4,可见所涉及到的反应类型有化合、氧化还原反应、非氧化还原反应和非离子反应。故选C。
2.今有NH3、O2、NO2在标准状况下的混合气体20.16L,通过稀硫酸后,溶液质量增加了34.1g,气体缩小至2.24L(标况下),将余烬木条插入其中,木条不复燃,则原混合气NH3、O2、NO2物质的量比为( )
A.1∶1∶7 B.2∶2∶5 C.3∶1∶4 D.5∶2∶2
A解析:此题可不用计算直接根据O2与NO2在溶液中的反应关系4NO2+O2+2H2O=4HNO3,剩余的NO2与水反应为3NO2+H2O=2HNO3+NO.从题意知放出的2.24L气体是NO,所以NO2与O2物质的量比一定大于4∶1,只有选项A符合题意。
1.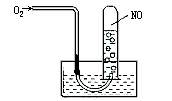 如图所示,当向试管内通入21mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为( )
如图所示,当向试管内通入21mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为( )
A.6mL B.12mL C.16mL D.18mL
B解析:此类题可导出NO和O2混合气体溶于水的关系式: 4NO+3O2+2H2O=4HNO3,从上式可知:当VNO∶VO2=4∶3时,混合气体完全与水反应,无气体剩余,当VNO∶VO2≠4∶3时,可能O2剩余或NO剩余。据本题意,可推知O2剩余,且剩余量与原NO体积相同。设原试管中NO为x mL,则有4∶3=x∶(21-x),解得x=12,故应选B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com