
30.(6分)白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为 g/mol。
(2)另取4.05g白玉粉末加入1mol/L的盐酸100mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336Ml(STP)。则①p=
;②白玉的化学式为 。
29.(10分)某芳香族化合物A的结构简式是 (其中R为饱和烃基),A在
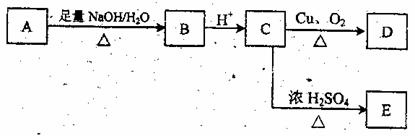 一定条件下有如图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
一定条件下有如图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(1)E的分子式是 。
(2)关于上述各步转化中,下列说法正确的是 。
A.以上各步没有涉及加成反应
B.E比C的相对分子质量小18
C.A、B、C、D中都含有-COOH
D.A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式: (①分子中笨环上有三个取代基,且苯环上的一氯代物有两种②1 mol该有机物与足量银氨溶液反应能产生4 molAg)。
(4)针对以下不同的情况分别回答:
①若E能使溴的上氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
27.(12分)为测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),供量气用,乙管可上下移动,用来调节液面高低。
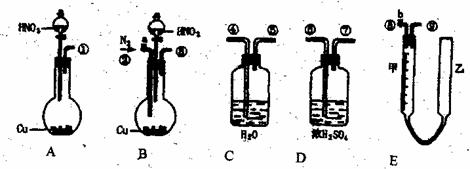
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择 (填装置序号)。
(2)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝具有强酸氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
(3)装置的连接顺序是(填各装置接口的编号,连接胶管及夹持装置均省略) 。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向E装置右管中加适量水;
第二
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是 。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m= 。
26.(12分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下:
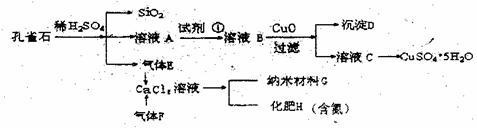
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 。
加入CuO作用是
(2)由溶液C获得CuSO4·5H2O,需要经过 操作。
除烧杯外、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入) (填化学式)。写出该反应的化学方程式
(4)欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应作用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
25.(8分)
(1)2009年9月至今,我国各个地区也接连暴发甲H1N1流感(或称H1N1型猪流感)疫情,防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感。二氧化氯 是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。请写出反应的离子方程式:
。
是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。请写出反应的离子方程式:
。
(2)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1molHClO2发生分解反应时,转移的电子个 数是
。
数是
。
(3)有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为 。
(4)完成下列方程式:
3Fe+1NO-2+ OH-→3FeO2-2+1H2O 。
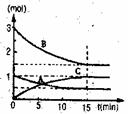
24.(1)在某容积不变的密闭容器中,有可逆反应:
 Ma(g)+Nb(g) pC(g)+qD(g)+Q(Q>0)
Ma(g)+Nb(g) pC(g)+qD(g)+Q(Q>0)
如图某反应过程中各物质的量n(mol)随时间t(min)的
变化曲线图。达到化学平衡:
①该反应的平衡常数表达式为 ;
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变)。正反应速率 (填增大、减小、不变)
③若体积为10升的密闭容器中,500°C、有催化剂存在的条件下,根据图示回答下列问题;在0~15min内的平均反应速率:v(B)= 。

 (2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。若该反应的正反应速率与时间关系如下图所示。在其它条件不变的情况下,请填空:
(2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。若该反应的正反应速率与时间关系如下图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是 (用文字表达)
②写出t4时改变的条件可能是 (用编号表
示,多选扣分)
A.增大压强 B.减小压强
C.使用催化 剂 D.升高温度
剂 D.升高温度
E.增大A的浓度
23.现有A、B、C、D四种短周期元素(零族除外),请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
元素非金属性较强,其最高价氧化物对应的水化物为强酸,但其单质稳定,常作保护气。 |
原子核外电子占了4个轨道 |
原子半径仅比氢原子大,其氢化物溶于水形成弱酸 |
其原子核外有13种运动状态的电子 |
(1)A元素原子单质电子式为: ,B元素在元素周期有中的位置是 。
(2)写出C元素单质与水反应的化学方程式 ;
A、C两元素的氢化物的稳定性强弱是 > (用化学式表示)
(3)D元素最高价氧化物对应的水化物呈 (填:酸性、碱性或非极性),能说明这一结论的电离方程式为 。
 (4)B元素最简单的氢化物分子为
分子(填:极性或非极性)。8g该氢化物在空气中完全燃烧生成液态水时,放出445.15kJ热量,该反应的热化学方程式为
(4)B元素最简单的氢化物分子为
分子(填:极性或非极性)。8g该氢化物在空气中完全燃烧生成液态水时,放出445.15kJ热量,该反应的热化学方程式为
22.某稀硫酸和硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉的质量增加的变化如下图所示。下列分析或结果正确的是 ( )
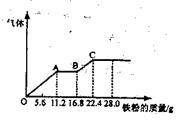 A.混合酸中NO-3物质的理为0.2mol
A.混合酸中NO-3物质的理为0.2mol
B.OA段产生的是NO,AB段的反应为:
Fe+2Fe3+→3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5mol·L-1
第二卷(共84分)
21.①pH=3的CH3COOH溶液;②Ph=3的HCl溶液;③Ph=11的氨水;④pH=11的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
A.将②、③溶液混合后,pH=7,消耗溶液的 体积:②>③
体积:②>③
B.水电离产生的c(H+):①=②=③=④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量;②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com