
26.(10分)有机物A可作为合成降血脂药物安妥明( )
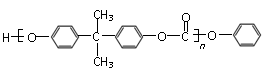
和某聚碳酸酯工程塑料( )的原料之一。
已知:
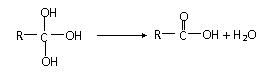 ①如下有机物分子结构不稳定,会发生变化:
①如下有机物分子结构不稳定,会发生变化:
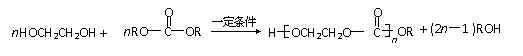 ②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
相关的合成路线如下图所示。
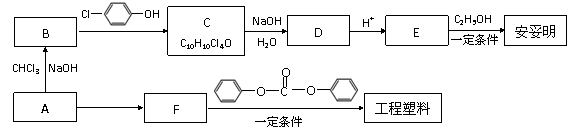
(1)经质谱测定,有机物A的相对分子质量为58,燃烧2.9 g有机物A,生成标准状况下3.36 L CO2和2.7 g H2O,A的核磁共振氢谱只出现一个吸收峰。则A的分子式是 。
(2)E→安妥明反应的化学方程式是 。
(3)C可能发生的反应类型(填选项序号) 。
a.取代反应 b.加成反应 c.消去反应 d.还原反应
(4)F的结构简式是 。
(5)写出同时符合下列条件的,E的同分异构体X的结构简式(只写1种即可) 。
①X能与饱和溴水发生取代反应
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1 mol X与足量NaHCO3溶液反应生成1 mol CO2,与足量Na反应生成1 mol H2
④X与NaOH水溶液发生取代反应所生成的官能团能被连续氧化为羧基
北京市西城区2010年抽样测试
25.(6分)与淀粉相关的物质间转化关系如下图所示。其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色。


(1)B的结构简式是 。
(2)E→F的化学方程式是 。
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉 ②加热3-4 min ③加入少量新制的Cu(OH)2悬浊液 ④加入少量稀硫酸 ⑤加热
⑥待冷却后,滴加NaOH溶液至溶液呈碱性。则以上操作步骤正确的顺序是(填选项序号) 。
a.①②④⑤③⑥ b.①④②③⑤⑥ c.①④②⑥③⑤ d.①⑤③④⑥②

24.(10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y
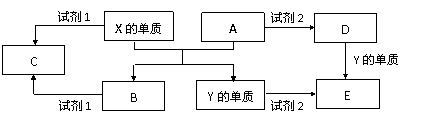 的单质是生活中常见的金属,相关物质间的关系如下图所示。
的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示) 。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
23.(10分)某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
|
第1组 |
第2组 |
第3组 |
|
S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
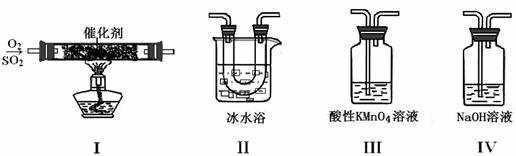
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是 ;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol•L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的化学方程式是 。
22.(6分)海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可) 。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是 。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为 。
21.(6分)Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2∶1反应形成盐丙。
(1)甲的电子式是 。
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是 。
(3)向少量丙溶液中加入浓Ba(OH)2溶液至过量并加热,反应的离子方程式是 。
20.(4分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,
则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
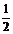 H2(g) + O2(g)
H2(g) + O2(g)  H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
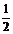 CO(g) + O2(g)
CO(g) + O2(g)  CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
则煤的气化主要反应的热化学方程式是
C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ•mol-1。
CO(g) + H2(g) ΔH= kJ•mol-1。
19.(4分)合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH<0 具有重要的意义。
(1)该反应的化学平衡常数表达式是K= 。
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
|
T / K |
473 |
573 |
673 |
…… |
|
K |
4.4×10-2 |
K1 |
K2 |
…… |
其中,K1 K2(填“>”、“=”或“<”)。
18.为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol B.0.01 mol C.0.025 mol D.0.03 mol
第Ⅱ卷(非选择题 共56分)
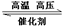
17.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com