
25. 第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外
层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x的单质一定是良好的半导体材料
D.x元素在常温下稳定存在的氧化物一定能与烧碱反应
II卷 非选择题
24.下列结论错误的是( )①微粒半径:K+>Al3+>S2->C1-
②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
23.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A.食盐和葡萄糖分别溶解在水中 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.液溴和苯分别受热变为气体
22. 下列电子式中错误的是
A.
Na+ B. 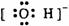 C.
C. 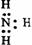 D.
D. 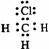
21.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
20.设NA为阿佛加德罗常数,下列叙述中正确的是( )
A. 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D. 26 g 苯和乙炔混合气体中含有分子数为NA
19.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
18.A和B是前三周期的元素,它们的离子A2-、B3+具有相同的电子层结构。下列说法中正确的是( )
A.原子序数:A>B B.原子半径:A>B C.离子半径:A2->B3+ D.质量数:A>B
17.下列反应离子方程式正确的是( )
A. 向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br- + 2Cl2= Fe3+ +Br2 + 4Cl-
B.向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O- → 2C6H5OH + CO32-
C.向小苏打溶液中加入醋酸溶液:HCO3- + H+ = CO2↑+ H2O
D. 向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH- = AlO2- + 2H2O
16.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com