
18.下列实验数据记录正确的是
A.用天平称取4.0克NaOH固体,用100ml量筒配制1.0000mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液 22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,用气球收集500mlNO2气体,求得NO2气体的物质的量为0.5/22.4mol
17.已知常温常压和催化剂条件下,N2(g)和H2(g)生成2molNH3(g)放出92.4kJ的热量。在上述条件下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.9molN2、2.7molH2和0.2molNH3,相同条件下达到平衡时放出热量为Q2kJ.则下列关系式正确的是
A.2Q=Q1=92.4 B.Q2<Q1<92.4
C.Q1<Q2<92.4 D.Q1=Q2=92.4
16.下列叙述正确的是
A.任何晶体中,若含有阳离子也一定含有阴离子
B.原子晶体中只含有共价键
C.离子晶体中只含有离子键
D.分子晶体中只存在分子间作用力,不含有其它化学键
15.有两种短周期元素X和Y,可以组成XY3,当Y的原子序数为M时,X的原子序数可能为①M-4 ②M+4 ③M+8 ④M-2 ⑤M+6,其中正确的是
A.①②④ B.①②③⑤ C.①②③④⑤ D.①②⑤
14.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是
A.稀盐酸 Na2CO3溶液 B.AlCl3溶液 NaAlO2溶液
C.Fe HNO3溶液 D.浓氨水 AgNO3溶液
13.下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
12.在下列各说法中,正确的是
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
11.在一个体积可变的密闭容器中,盛有等物质的量的SO2、O2、SO3(g)的混合气体,在一定温度和压强下,反应达到平衡时,容器中混合气体的密度比反应前减少了1/13(温度、压强反应前后不变),则反应达到平衡时,混合气体中SO2占总体积的
A.1/3 B.1/6 C.2/13 D.6/13
10.右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol·L-1, 工作一段时间后,测得导线上都通过了
 0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是
0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;
②中负极:2H++2e一=H2↑
D.溶液的pH:①不变;②增大
9.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Fe2+、K+、Cl- 、NO3- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2- 、K+
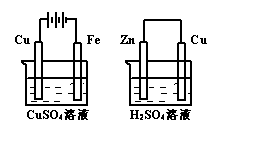
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com