
15.某主族元素R原子的质量数为79,已知R离子含有45个中子和36个电子,下列有关R的叙述错误的是
A.R最高价氧化物对应的水化物的化学式为H3RO4 B.R位于第四周期VIA族
C.元素R气态氢化物的化学式为H2R D.R的阴离子具有强还原性
14.实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
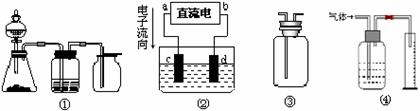
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积的装置
13.下列离子方程式中正确的是
A. 过量的NaHSO4与Ba(OH)2溶液反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
12.某化学兴趣小组设计了下列四个实验装置,试图通过观察实验现象说明CO2与NaOH溶液发生了反应。其中无法达到实验目的的是
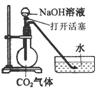
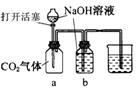
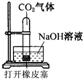
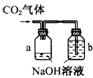
A B C D
11.下列过程都与热量变化有关,其中表述不正确的是
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为
CO (g)+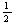 O2(g) === CO2 (g);△H=-283.0 kJ/mol
O2(g) === CO2 (g);△H=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
1/2H2SO4(l)+ KOH(l)=1/2K2SO4(l)+H2O(l);△H= -57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
10.NaH是-种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A. 跟水反应时,水作氧化剂 B. NaH中H-半径比Li+半径小
C. 跟液氨反应时,有NaNH2生成 D. 跟乙醇反应时,NaH被氧化
9.下列说法中,正确的是
A.NH4+ 与HCO3-均可以水解,故NH4HCO3是弱电解质
B.25℃时,l L pH=3的盐酸与1L pH=11的氨水能恰好中和
C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5
D.25℃时,pH=14的溶液中,Na+、CO32-、K+、CIO-可以大量共存
8.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A. H3O+、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+
C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
7.X、Y、Z、W均为短周期元素,X、Y同主族,X元素的原子有2个电子层,每层上均有2个电子;Z处于第2周期第ⅤA族;W元素是地壳中质量分数第二的元素,其单质是现代信息技术中应用的重要材料之一。下列叙述正确的是
A.X、Y最高价氧化物对应水化物的碱性相比,X>Y
B.X元素的原子半径比Z元素原子半径小
C.Z元素的非金属性一定比W元素的非金属性强
D.Z的单质不能助燃,因此Y的单质在Z的单质中不能燃烧
6.下列叙述正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.X、Y均为短周期元素,其简单离子mXa+与nYb-的电子层结构相同,则m+a=n-b
C.F、Cl、Br的最外层电子数都是7,次外层电子数都是8
D.结合质子(H+)能力:OH->CH3COO->Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com