
3.若函数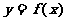 的值域是[
的值域是[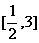 ,则函数
,则函数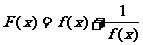 的值域是( )
的值域是( )
A.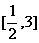 B.
B.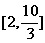 C.
C.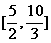 D.
D.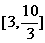
2.已知等差数列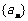 的公差为2,若前17项和为
的公差为2,若前17项和为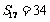 ,则
,则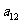 的值为( )
的值为( )
A.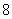 B.
B.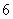 C.
C.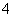 D.
D.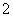
1.设集合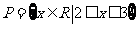 ,集合
,集合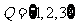 ,则下列结论正确的是( )
,则下列结论正确的是( )
A.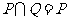 B.
B.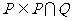 C.
C.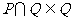 D.
D.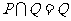
29.(5分)(1)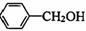 1分
1分
(
28.(8分)
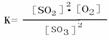 (1) (1分)
(1) (1分)
(2)0.0125mol/L•min (1分
(3) 增大,增大,减小 (各1分) (4) b、c (2分) (5) c (1分)
27.(8分)
(1)O2 (1分)
(2)3Cu + 8HNO3-- 3Cu(NO3)2 + 2NO↑+ 4H2O (2分)
湿润的红色石蕊试纸变蓝色 (2分)
(3)2Cl-+2H2O===Cl2+H2+2OH- (2分)
(4)AlO2- (1分)
30.(16分)I.(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸;能随即发生剧烈反应的是(填序号,下同) ,常温下缓慢反应(或微热后能发生剧烈反应)的是 ,常温下不反应,但加热后发生剧烈反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸的氧化性由强到弱的顺序是: __________。
(2)工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是 (填序号)
A.Cu + HNO3(浓)Cu(NO3)2 B.Cu + HNO3(稀)Cu(NO3)2
C.Cu空气△ CuO浓硝酸 Cu(NO3)2 D.Cu浓硫酸△ CuSO4Ba(NO3 Cu(NO3)2
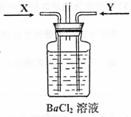 (3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
(3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
A.通入X气体后产生白色沉淀;
B.通入X气体后溶液中无明显现象;
C.通入Y气体后开始沉淀;
D.通入Y气体后沉淀溶解 ;
E.通入Y气体后溶液中无明显现象。
由此可得到的结论是:
A.HNO3的酸性比H2SO4强 B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸 D.HNO3能氧化H2SO3(或SO2)
 E.BaSO4不溶于水也不溶于HNO3溶液
E.BaSO4不溶于水也不溶于HNO3溶液
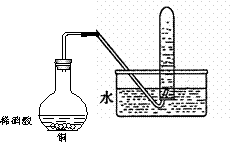
Ⅱ.右图是用过量的铜与40mL稀硝酸在100mL烧瓶中
反应制取一氧化氮气体的实验装置图,请回答下列问题:
(1)反应刚开始时的现象是________________,
反应停止时的现象是___________________,
(2):①、从烧瓶中取出少量反应后的溶液,滴入少量氨水,写出该反应的离子方程式_________:
②、反应结束后,能否采取向烧瓶中加入稀硫酸的方式,再获得一氧化氮气体?如果可以,请写出反应的离子方程式,如果不可以,请说明理由___________________
2010届第一学期新安江中学、寿昌中学、严州中学(梅)
高三联考化学评分标准
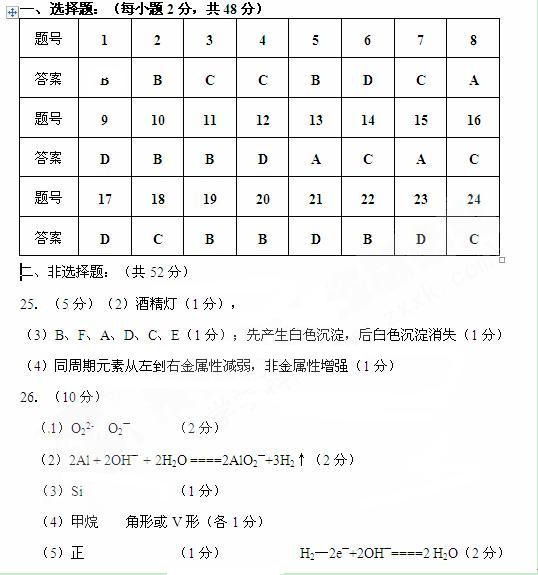
29.(5分)(茉莉花)是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(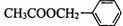 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
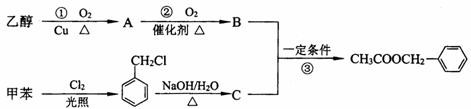
(1)C的结构简式为__________________________。
(2)写出反应①的化学方程式:_______________________________。
(3)反应③的反应类型为______________________________。
(4)反应__________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
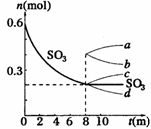
28.(8分)在一个2L的密闭容器中,发生反应2SO3(g)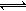 2SO2(g)+ O2(g);△H >0,其中SO3的变化如下图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如下图所示:
(1)写出该反应的平衡常数表达式 ________________ 。
(2)用O2表示0-8min内该反应的平均速率v= 。
 (3)升高温度,该反应的反应速率将
;K值将
;容器中气体的平均相对分子质量将
。(填“增大”“减小”或“不变”)
(3)升高温度,该反应的反应速率将
;K值将
;容器中气体的平均相对分子质量将
。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v 逆(SO2)=2v 正(O2) d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为
A. a B. b C. c D. d
27.(8分)已知A、B、C是中学化学常见物质,它们在一定条件下有如下转化关系[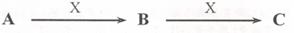
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”。则X的化学式为_________;
(2)若A为碱性气体,A、B、C均含同种元素,写出该元素的最高价氧化物的水化物的水溶液与某种亮红色金属反应生成C的化学方程式_______________,
如何检验气体A_____________________________________;
(3)若A、B、C的焰色反应均为黄色,A是一种工业原料,B俗称小苏打,电解C的水溶液可以得到两种气态产物,这两种气态产物在工业上可以合成X,则电解C的水溶液的离子方程式为__________________________;
(4)若A、C为无色溶液,X为强碱,其焰色反应为黄色,B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,则C溶液中除氢氧根外还存在的阴离子的化学式为____________;.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com