
1. 氧化性:
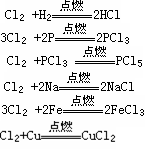 F2 + H2 === 2HF
2F2 +2H2O===4HF+O2
F2 + H2 === 2HF
2F2 +2H2O===4HF+O2
Cl2 +2FeCl2 ===2FeCl3
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
 Cl2+SO2 +2H2O===H2SO4 +2HCl(2004北京高考)
Cl2+SO2 +2H2O===H2SO4 +2HCl(2004北京高考)
19.(1)三 (2)Ca∶C∶O=10∶3∶12 (3)0.6g (4)①6.6g
②设参加反应的碳酸钙为x
CaCO3 +2HCl == CaCl2 + H2O +CO2↑
100 44
x 6.6g
100∶44=x∶6.6g x=15g
每片含碳酸钙的质量为:15/10=1.5g,(或15g/20g×100% = 75%)
故钙片中碳酸钙的含量标注属实。
18、(7分)⑴ ①酒精灯 ②分液漏斗 ⑵ A、D或F 2KMnO4 加热 K2 MnO4 + MnO2 + O2 ↑ (3)用弹簧夹夹紧乳胶管,向长颈漏斗中注入一定量的的水,会形成一段稳定的液注,则装置的气密性是好的. CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O 用燃着的木条放在集气瓶口,如木条熄灭,则已集满,否则没有集满。 ⑷液面下降,反应液被压回长颈漏斗,反应液与块状固体脱离,反应停止。
17.(1)通过上述实验,小明同学可得二氧化硫气体的三点性质,分别是:
①密度比空气大;②溶于水;③能与水反应。等
(2)将试管内的空气排干净。
16、(4分,第1问每空0.5分)⑴CaO Fe
⑵CO2+C  2CO Fe2O3+3CO
2CO Fe2O3+3CO  2Fe+3CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2Fe+3CO2 CO2+Ca(OH)2=CaCO3↓+H2O
15、略
14、(共8分,每空1分)(1)H2O, (2) +7 (3)保证足够多的空气,使燃料与空气最大的接触; 产生CO有毒气体,污染空气,浪费能源((1分,危害有两点,答出一点给0.5分)。
(4)作保护气,防止跟空气(O2)混合引起爆炸 (5)CH2+2O2 点燃 CO2+2H2O(1分); (6) 从长远角度考虑,节能灯节约的电费价格远超过购买一个节能灯泡的价格(,其他叙述合理亦可);随手关灯或节约用电、使用节能灶具、改良耗能机械结构等,(其他答案合理均给分)
13、(共5分,每空1分)第(1)16 (2)13 ; D ;(3)是 E 和 F (1分) (4)Al2O3
18.通过对化学的学习,你已经掌握了实验室制取气体的有关规律,请结合下图回答问题:
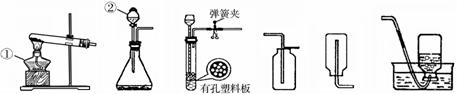
A B C D E F
(1)写出图中标号仪器的名称① ②
(2)用加热高锰酸钾的方法制取氧气,应选用发生装置和收集装置分别是 和 (填编号)。写出高锰酸钾受热分解的化学方程式 。
(3)用C装置( 石灰石与稀盐酸反应 )制取二氧化碳气体,如何检查装置的气密性:
;
反应的化学方程式为 。检验该气体是否收集满的方法是 。
 (4)实验室常用锌粒和稀硫酸反应制取氢气。若用C装置制取氢气,在有孔塑料板上放置的药品是锌粒,反应进行过程中,关闭该装置中的弹簧夹后,可以观察到的现象是 。19.右图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题。
(4)实验室常用锌粒和稀硫酸反应制取氢气。若用C装置制取氢气,在有孔塑料板上放置的药品是锌粒,反应进行过程中,关闭该装置中的弹簧夹后,可以观察到的现象是 。19.右图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题。
(1)主要成分碳酸钙由 种元素组成。
(2)碳酸钙中各元素的质量比为 。
(3)每片钙片中至少含钙元素的质量为 g。
(4)小花同学为测定其中碳酸钙的含量标注是否属实,她取出10片钙片,研碎后放入小烧杯中,再加入50g稀盐酸,在T0至T3时间段,测得反应剩余物的质量变化如下:
|
时间 |
T0 |
T1 |
T2 |
T3 |
|
反应剩余物质量(g) |
70 |
65 |
63.4 |
63.4 |
①生成的二氧化碳的质量是多少?
②通过计算判断该钙片中碳酸钙的含量标注是否属实。
2009-2010年初中化学期末测试
第I卷(选择题 共36分)
第Ⅱ卷(共64分)
17.学习了二氧化碳性质后,某课外活动小组为了探究二氧化硫(SO2)的某些性质,进行了以下探究实验:下图中从左向右依次是某同学做的实验及相应现象。
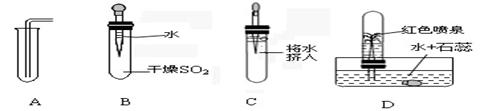
(1)通过上述实验,小明同学可得二氧化硫气体的三点性质,分别是:
① ;
② ;
③ 。
(2)A操作中,导气管要尽量接近试管底部,其目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com