
17、在密闭容器中,反应X2(g)+Y2(g) 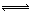 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
A.图Ⅰ是加入适当催化剂的变化情B.图Ⅱ是扩大容器体积的变化情况
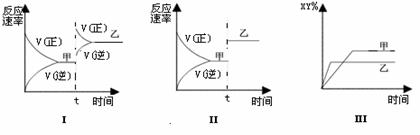 C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
16、某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四组实验:
① 将镁粉投入冷水中,未见任何现象;
② 将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③ 将镁粉放入液溴中,未观察到任何明显现象;
④ 向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
15.我国锑的蕴藏量占世界第一。提取单质锑一般是先在高温下将硫化物转为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS……①
Sb4O6+6C=4Sb+6CO………………②关于反应①、反应②的说法正确的是( )
A.反应①②中的氧化剂分别是Sb2S3. Sb4O6
B.反应①中每生成3mol FeS 时,共转移6mol 电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为 4∶3
14、关于反应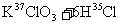

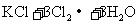 的有关叙述中,正确的是( )
的有关叙述中,正确的是( )
A.KCl中含有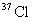 B.KCl中含有
B.KCl中含有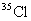
C.生成物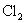 的相对分子质量大于71 D.该反应转移电子数为
的相对分子质量大于71 D.该反应转移电子数为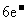
13.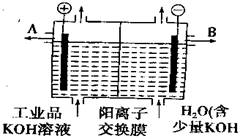 氢氧化钾是重要的工业产品,工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜电解提纯,电解槽内装有阳离子交换膜(只允许阳离子通过),其工业原理如下图所示:下列有关说法中错误的是( )
氢氧化钾是重要的工业产品,工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜电解提纯,电解槽内装有阳离子交换膜(只允许阳离子通过),其工业原理如下图所示:下列有关说法中错误的是( )
A.该电解槽的阳极反应式为4OH--4e-=2H2O+O2↑
B.通电开始后,阴极附近溶液的PH会增大
C.K+可从阳极区进入阴极区和OH-组成KOH
D.除去杂质后的KOH溶液从液体出口A导出
12.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原,现用15.00mL 0.049 mol/L羟胺的酸性溶液与足量硫酸铁溶液反应(Fe3+转变为Fe2+)。生成的Fe2+ 恰好与24.50mL 0.020 mol/L KMnO4酸性溶液完全作用:2KMnO4 + 6FeSO4 + 4H2SO4 = 3Fe2(SO4)3 + K2SO4 + 4H2O + 2MnO2,则上述反应中羟胺的氧化产物为( )
A.N2 B.N2O C.NO D.NO2
11、 如右图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能
如右图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能
发生化学反应(已知高温时氨气能还原
Fe2O3。)图中①表示的物质是( )
A.Al B.NaOH溶液
C.氢碘酸 D.O2或Fe2O3
10、现有CuO和Fe2O3组成的混合物a g,向其中加入4.0 mol•L–1硫酸溶液25 mL时恰好完全反应。若将a g原混合物在足量CO中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6 g B.1.6a g C.(a-0.8) g D.(a-1.6) g
9、 有100 mL 溶质为MgCl2和AlCl3的混合溶液,c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是
A.25mL B.5mL C.30mL D.100mL
8. 下列各组离子在指定条件下,-定能大量共存的是( )
下列各组离子在指定条件下,-定能大量共存的是( )
①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO32-、NO3-、AlO2-
②c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
③能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
④水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
⑤在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
⑥在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
⑦含有大量S2-的溶液:Na+、C1O-、C1-、CO32-
⑧能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
A.①② B.①③ C.②④ D.②⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com