
20.用惰性电极以直流电串联电解分装在甲、乙两烧杯中的200mL0.3 mol·L-1 NaCl溶液和300mL0.2 mol·L-1的AgNO3溶液,当产生0.56L(标准状况下)Cl2时停止电解,取出电极,将两杯溶液混合,则混合液的pH为(设混合后溶液的总体积为500mL)
A.1.4 B.7 C.5.6 D.12.6
19.关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>① B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH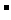 )+c(NH3·H2O)
)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl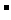 )>c(OH
)>c(OH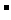 )>c(H+)
)>c(H+)
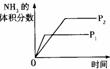
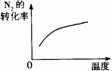
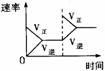
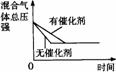
18.对于可逆反应N2(g)+3H2(g)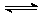 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
|
|
A |
B |
C |
D |
|
研究目的 |
压强对反应的影响(P2﹤P1) |
温度对反应的影响 |
增加N2对反应的影响 |
催化剂对反应的影响 |
|
图示 |
 |
 |
 [ [ |
 |
16.有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是
A.Na2SO3已部分被空气中的氧气氧化 B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 C.此实验不能确定Na2SO3是否部分被氧化
D.加硝酸后的不溶性沉淀不一定是BaSO4 17.某无色溶液中可能含有I-、Cu2+ 、SO32-、 NH4+ ,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I-; ②肯定不含Cu2+ ③肯定含有SO32-; ④可能含有I-;
⑤可能含有SO32-;
A.①②③ B.②④⑤ C.①②⑤ D.②③④
15.某主族元素R原子的质量数为79,已知R离子含有45个中子和36个电子,下列有关R的叙述错误的是
A.R最高价氧化物对应的水化物的化学式为H3RO4 B.R位于第四周期VIA族
C.元素R气态氢化物的化学式为H2R D.R的阴离子具有强还原性
14.实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
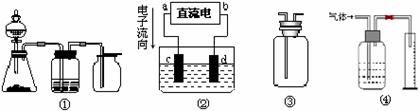
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积的装置
13.下列离子方程式中正确的是
A. 过量的NaHSO4与Ba(OH)2溶液反应:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
12.某化学兴趣小组设计了下列四个实验装置,试图通过观察实验现象说明CO2与NaOH溶液发生了反应。其中无法达到实验目的的是
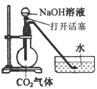

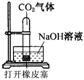
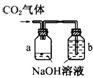
A B C D
11.下列过程都与热量变化有关,其中表述不正确的是
A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为
CO (g)+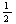 O2(g) === CO2 (g);△H=-283.0 kJ/mol
O2(g) === CO2 (g);△H=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
1/2H2SO4(l)+ KOH(l)=1/2K2SO4(l)+H2O(l);△H= -57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
10.NaH是-种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A. 跟水反应时,水作氧化剂 B. NaH中H-半径比Li+半径小
C. 跟液氨反应时,有NaNH2生成 D. 跟乙醇反应时,NaH被氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com