
考点4.有关图像及数据分析题(探究性考点)
解有关图像、数据分析题时,都涉及化学反应,以化学方程式等化学知识作为分析推理的主要依据,分析图像及实验数据时要抓住“突破口”,以此为基础,逐层推导,分类讨论、判断、计算。
第六单元 碳和碳的氧化物
第14讲 碳及一氧化碳的性质、用途
考点3.有关天平平衡问题的计算(拓展考点)
有关天平平衡问题的计算一般是在平衡的天平两边的反应容器内加入不同的反应物,通过计算判断天平是否平衡。解答天平平衡问题可采用如下分析方法:设加到天平左、右两盘容器内的物质质量分别为m(左入)、m(右入);左、右两盘容器内放出的气体质量分别为m(左出)、m(右出);左、右两盘实际增重为△m(左)、△m(右),即△m(左)= m(左入)- m(左出);△m(右)= m(右入)- m(右出)。
则当△m(左)
正确找出或求出m(左入)、m(左出)、m(右入)、m(右出)是解此类题的关键。
考点1.有关纯净物的化学方程式的计算
有关纯净物的化学方程式的计算比较简单,但解题时要把握好三个要领,抓住三个关键,注意一个事项。三个要领:(1)步骤要完整;(2)格式要规范;(3)得数要准确。三个关键:(1)准确书写化学式;(2)化学方程式要配平;(3)准确计算相对分子质量。
考点2.反应物(或生成物)不纯的计算
化学方程式反映的是纯净物间的质量关系,因此,遇到不纯物时,要先把不纯的反应物(或生成物)的质量换算成纯净物的质量,再代入化学方程式进行计算。进行化学计算时,要注意“纯度”与“杂质质量分数”的区别。“纯度”是指在一定质量的不纯物质中纯净物质(主要成分)所占的质量分数,而“杂质质量分数”是指不纯物质中的杂质所占的质量分数。
 。
。
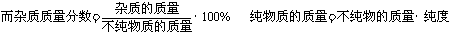 。
。
考点3.质量守恒定律的应用(实际应用考点)
(1)根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。利用这一定律可以解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
(2)根据质量守恒定律,化学反应前后元素的种类和质量不变,由此可以推断反应物或生成物的组成元素。
考点4.质量守恒定律与化学方程式的综合应用(学科内综合考点)
(1)根据质量守恒定律:化学反应前后元素的种类和数目相等,推断反应物或生物的化学式。
(2)已知某反应物或生成物质量,根据化学方程式中各物质的质量比,可求出生成物或反应物的质量。
第13讲 根据化学方程式的计算
考点1.质量守恒定律
(1)质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。①质量守恒定律适用的范围是化学变化而不是物理变化;②质量守恒定律揭示的是质量守恒而不是其他方面的守恒。物体体积不一定守恒;③质量守恒定律中“参加反应的”不是各物质质量的简单相加,而是指真正参与了反应的那一部分质量,反应物中可能有一部分没有参与反应;④质量守恒定律的推论:化学反应中,反应前各物质的总质量等于反应后各物质的总质量。
(2)质量守恒定律的微观解释:在化学反应过程中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以化学反应前后各物质的质量总和必然相等。①化学变化中的“一定不变”:原子种类、原子数目、原子质量、元素种类、反应前后各物质的总质量一定不变;②化学变化中的“一定改变”;分子种类、物质种类一定改变;③化学变化中的“可能改变”:分子数目可能改变。
考点2.化学方程式
(1)定义:用化学式来表示化学反应的式子。(2)书写原则:①必须以客观事实为依据;②必须遵守质量守恒定律。(3)书写方法:①正确书写反应物和生成物的化学式;②配平化学方程式,然后将连线改为等号;③注明化学反应的条件及生成物的状态等。(4)配平化学方程式的方法:观察法、最小公倍数法、奇数配偶数法等。(5)化学方程式的读法:从左到右,先读反应物,后读生成物,反应物中“+”号读成“跟”、“与”或“和”。生成物中“+”读“和”。“==”读成“生成”。条件读“在……条件下反应”。(6)化学方程式表示的意义:①表示反应物、生成物以及反应条件;②表示反应物、生成物各物质之间的质量比;③表示反应物、生成物的各粒子的相对数量关系。
考点3.元素的化合价与化学式的关系(拓展考点)
(1)根据化合价写化学式:一般把正价元素或原子团写在左边,负价元素或原子团写在右边;将正负化合价绝对值相约至最简整数后,将其交叉写在元素符号或原子团的右下角。(2)根据化学式确定化合价:依据化合物中正负化合价代数和为零的原则;依据原子团中正负化合价代数和为根价的原则,计算确定。
考点4.相对分子质量及其计算(学科内综合考点)
(1)概念:化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。
(2)有关化学式的计算:①根据化学式可以计算物质的相对分子质量。计算公式:相对分子质量=(相对原子质量×原子个数)之和。②根据化学式可以计算物质中各元素的质量比。计算公式:元素质量比=(相对原子质量×原子个数)之比。③根据化学式可以计算物质中某元素的质量分数。计算公式:元素的质量分数= 。④化合物中某元素的质量=化合物的质量×该元素的质量分数。
。④化合物中某元素的质量=化合物的质量×该元素的质量分数。
第五单元 化学方程式
第12讲 质量守恒定律 化学方程式
考点1.化学式
(1)概念:用元素符号来表示物质组成的式子。
(2)化学式的书写方法:①单质的化学式:a.稀有气体单质、金属单质及部分非金属单质(如硫、磷等)是由单原子构成,其化学式直接用元素符号表示。如:He、Ne、Fe、Mg、C、S、P。b .常温下是气态的非金属单质,一般为双原子分子,在其元素符号右下角写上“2”,即表示其化学式,例如:O2、H2、Cl2、N2等。②化合物的化学式:a.弄清这种化合物是由哪几种元素组成的以及不同元素原子的个数比是多少;b .当其组成元素原子个数比是1时,1可省略;c.化合物为氧化物时,一般把氧的元素符号写在右方,另一种元素的符号写在左方,如CO2;d.由金属元素和非金属元素组成的化合物,书写时一般把金属的元素符号写在左方,非金属的元素符号写在右方,如NaCl。
(3)化学式表示的意义:①由分子构成的物质,其化学式意义(以CO2为例):


②由原子构成的物质,其化学式的意义(以Fe为例):

微观:表示该物质的一个原子:一个铁原子。
考点2.元素的化合价
(1)元素的化合价是元素的原子在形成化合物时表现出来的一种性质。化合价的对象是元素而不是物质。化合价有正价和负价。单质中元素的化合价为零。化合物中元素正负化合价的代数和为零。
(2)化合价的表示方法:①位置:元素符号的正上方(如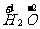 );②书写顺序:先写正负,后写数值;③化合价与离子表示方法的异同点。相同点:化合价和离子电荷的正负与数值相同。
);②书写顺序:先写正负,后写数值;③化合价与离子表示方法的异同点。相同点:化合价和离子电荷的正负与数值相同。
 (3)常见元素的化合价。熟记常见元素的化合价,钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧为负二价;铜汞正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四六。
(3)常见元素的化合价。熟记常见元素的化合价,钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧为负二价;铜汞正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四六。
(4)化合价的应用:①根据化合价求化合物的化学式:正价左、负价右;标化合价;求原子个数: =原子个数;检查。②根据化学式确定元素或根的化合价。
=原子个数;检查。②根据化学式确定元素或根的化合价。
考点4.离子及离子的形成(学科内综合考点)

 (1)离子的概念:带电的原子(或原子团)叫做离子。带正电的叫阳离子(或正离子),带负电的叫阴离子(或负离子)。
(1)离子的概念:带电的原子(或原子团)叫做离子。带正电的叫阳离子(或正离子),带负电的叫阴离子(或负离子)。
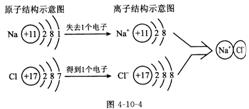
(2)原子与离子的转化:原子 阳离子,原子 阴离子;根据原子核外最外层电子排布的特点可知:金属元素的原子易失去电子形成阳离子;非金属元素的原子易得到电子形成阴离子。
(3)离子的表示方法:在元素符号的右上角用“+”、“-”号表示离子的电性,数字表示离子所带的电荷,先写数字后写正负号,当数字为1时,应省略不写。如:Na+、Cl-、Mg2+、O2-。
(4)离子符号的意义:
①数字的意义:3Mg2+-表示每个镁离子带2个单位正电荷

表示3个镁离子
 ②符号的意义:3Mg2+表示3个镁离子
②符号的意义:3Mg2+表示3个镁离子
(5)离子结构意图(如图4-10-4)
(6)离子化合物和共价化合物:①离子化合物:由阴、阳离子相互作用而构成的化合物,离子化合物由离子构成。②共价化合物:以共用电子对形成分子的化合物为共价化合物,共价化合物是由分子构成的。
考点5.元素周期表(拓展考点)
物质世界是由100多种元素组成的,为了便于研究元素的性质和用途,寻求它们内在的规律性,科学家们根据元素的原子结构和性质,把它们科学有序地排列起来,就得到了元素周期表。
(1)元素周期表的结构:①每一格:在元素周期表中,每一种元素的均占据一格。对于每一格,均包括原子序数、元素符号、元素名称、相对原子质量等内容。在周期表中,还用不同颜色对金属元素、非金属元素做出了区分。②每一横行(周期):周期表每一横行为一个周期,共有7个横行,即7个周期。③每一纵行(族):周期表在18个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每个纵行为一族,共有16个族。
(2)元素周期表编排原则:①按原子序数递增的顺序从左到右排列。以金属元素开头(除第一周期),慢慢过渡到非金属元素,稀有气体结尾;②将电子层数相同的元素排成一个横行。按照最外层电子数递增的顺序从左到右排列;③把最外层电子数相同的元素(个别除外)排成一个纵行。元素周期表是元素性质的周期性变化,即原子结构周期性变化的具体体现。
 考点6.物质的构成与组成及分类的有关知识(学科内综合考点)
考点6.物质的构成与组成及分类的有关知识(学科内综合考点)
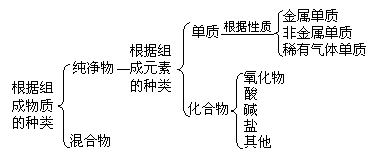
(2)物质的简单分类:
第11讲 化学式与化合价
考点1.原子的构成
 (1)原子结构。
(1)原子结构。
②不同种类的原子,核内的质子数不同,核外的电子数也不同。③在原子中,核电荷数=质子数=核外电子数。原子核内的质子数不一定等于中子数,由于原子核所带电量和核外电子所带电量相等,且电性相反,因此,整个原子呈电中性。④并不是所有原子的原子核都是由质子和中子两种微粒构成的,在所有原子中,普通氢原子的原子核内只有质子,没有中子。
(2)相对原子质量:①相对原子质量的定义:以碳12(含有6个质子和6个中子的碳原子)原子质量的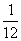 作为标准,其他原子的质量与它相比较所得的比,就是该种原子的相对原子质量。②计算公式:相对原子质量的符号为Ar,相对原子质量(Ar)=
作为标准,其他原子的质量与它相比较所得的比,就是该种原子的相对原子质量。②计算公式:相对原子质量的符号为Ar,相对原子质量(Ar)= ;相对原子质量≈质子数+中子数。③注意问题:a.相对原子质量是个比值,单位为“1”(通常省略不写),它不表示原子的实际质量。b.由于质子和中子的质量近似相等,都约为一个电子质量的1836倍,故电子的质量可以忽略不计,原子的质量主要集中在原子核上。c.原子的实际质量与相对原子质量成正比。④相对原子质量与原子的质量的比较(见表4-10-1):
;相对原子质量≈质子数+中子数。③注意问题:a.相对原子质量是个比值,单位为“1”(通常省略不写),它不表示原子的实际质量。b.由于质子和中子的质量近似相等,都约为一个电子质量的1836倍,故电子的质量可以忽略不计,原子的质量主要集中在原子核上。c.原子的实际质量与相对原子质量成正比。④相对原子质量与原子的质量的比较(见表4-10-1):
表4-10-1
|
|
原子质量 |
相对原子质量 |
|
来源 |
测定出来的 |
比较出来的 |
|
性质 |
绝对的 |
相对的 |
|
数值 |
非常小 |
≥1,大多数为整数 |
|
单位 |
kg |
单位是1 |
|
以碳12为例 |
1.993×10-26kg |
12 |
|
联系 |
相对原子质量=原子的质量÷一个碳12原子质量的1/12(原子的质量越大,其相对原子质量也越大) |
考点2.元素与元素符号
(1)元素:①定义:具有相同核电荷数(即核内质子数)的一类原子的总称。②性质:a. 元素是个宏观概念,它只能组成物质而不能构成分子或原子;b. 元素只讲种类不讲个数;c. 化学变化中,元素的种类和质量保持不变。③分类:元素可分为金属元素、非金属元素和稀有气体元素三大类。④含量:a. 在地壳中,氧元素最多,其次为硅、铝、铁等元素;b. 在空气中,氮元素最多,其次是氧元素;c. 在生物体中,氧元素最多,其次是碳元素和氢元素。⑤决定:质子数决定了元素的种类,不同元素的区别是因为它们的质子数不相同。
(2)元素与原子的区别(见表4-10-2);
表4-10-2
|
项 目 |
元 素 |
原 子 |
|
|
定义 |
具有相同核电荷数(即核内质子数)的一类原子的总称 |
化学变化中的最小粒子 |
|
|
区别 |
含义 |
宏观概念,只表示种类不表示个数 |
微观概念,既表示种类又表示个数 |
|
使用范围 |
表示物质的宏观组成。如水是由氢元素和氧元素组成的 |
表示物质的微观构成。如1个水分子是由2个氢原子和1个氧原子构成的 |
|
|
联系 |
具有相同核电荷数(即质子数)的一类原子总称为元素 |
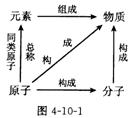 (3)物质、元素、分子、原子之间的关系(见图4-10-1);
(3)物质、元素、分子、原子之间的关系(见图4-10-1);
(4)元素符号:①写法:用拉丁文名称的第一个字母的大写来表示,如果第一个字母相同,还必须附加一个小写字母以示区别(110号元素以后除外)。②意义:宏观意义:表示一种元素;由原子直接构成的物质,其组成元素符号还表示这种物质。微观意义:表示该元素的一个原子。例如,“H”宏观意义表示氢元素,微观意义表示一个氢原子。③元素符号周围数字的意义:元素符号前面的数字表示原子个数,例如“2H”表示两个氢原子:元素符号右下角的数字表示一个分子中原子的个数,例如“H2O”中的数字表示一个水分子中含有两个氢原子。
考点3.核外电子的排布情况
 (1)核外电子排布:①电子层:电子在原子核外一定的区域内运动,这些区域称为电子层,核外电子是分层排布的。核外电子的分层排布是因为电子的能量各不相同,能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动。②核外电子排布的规律:第一层最多可容纳2个电子,第二导最多可容纳8个电子,最外层最多可容纳8个电子(最外层为第一层时,只能容纳2个电子)。核外电子总是从最内层开始依次向外排布。核外电子的排布规律很多,在高中阶段再继续学习。
(1)核外电子排布:①电子层:电子在原子核外一定的区域内运动,这些区域称为电子层,核外电子是分层排布的。核外电子的分层排布是因为电子的能量各不相同,能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动。②核外电子排布的规律:第一层最多可容纳2个电子,第二导最多可容纳8个电子,最外层最多可容纳8个电子(最外层为第一层时,只能容纳2个电子)。核外电子总是从最内层开始依次向外排布。核外电子的排布规律很多,在高中阶段再继续学习。
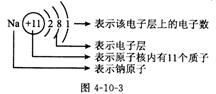
(2)原子结构示意图:①原子结构示意图各部分表示的意义(如图4-10-3所示)。②元素的性质与原子结构的关系。元素的性质元素的原子核外电子排布有密切的关系,特别是元素的化学性质跟它的原子的最外层电子数目关系更加密切。③分析1~18号元素的分类及原子结构示意图,得表4-10-3所示结论:
表4-10-3
|
元素分类 |
最外层电子数 |
结构的稳定性 |
化学性质 |
|
金属元素 |
一般<4(较少) |
不稳定 |
易失去最外层电子 |
|
非金属元素 |
一般≥(较多) |
不稳定 |
易得到电子 |
|
稀有气体元素 |
8(He为2个) |
稳定 |
难得失电子,一般参加化学反应 |
考点3.运用分子、原子的知识解释现象(拓展考点)
 日常生活中常见的一些现象,可从物理变化和化学变化中分子、原子的变化方面去分析。物质在发生物理变化时,分子本身没有变化,只是分子之间的距离与分子间位置发生变化而已。如水
日常生活中常见的一些现象,可从物理变化和化学变化中分子、原子的变化方面去分析。物质在发生物理变化时,分子本身没有变化,只是分子之间的距离与分子间位置发生变化而已。如水
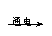 水蒸气,水分子本身没有发生变化,只是水分子间的间隔变大了,其化学性质也没有变化。物质在发生化学变化时,分子发生了本质的变化,变成了其他物质的分子,如水
氢气+氧气。新的分子的形成是原子重新组合的结果,因此化学变化中分子破裂成原子,原子重新组合成新的物质的分子。根据以上分析的原理可以从微观角度解释物质的变化现象。
水蒸气,水分子本身没有发生变化,只是水分子间的间隔变大了,其化学性质也没有变化。物质在发生化学变化时,分子发生了本质的变化,变成了其他物质的分子,如水
氢气+氧气。新的分子的形成是原子重新组合的结果,因此化学变化中分子破裂成原子,原子重新组合成新的物质的分子。根据以上分析的原理可以从微观角度解释物质的变化现象。
第四单元 物质构成的奥秘
第10讲 物质的构成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com