
考点1.酸碱指示剂
(1)定义:跟酸或碱溶液作用显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
(2)常用的指示剂:石蕊和酚酞是两种常用的指示剂,它们与酸溶液,碱溶液作用时显示的颜色见表10-22-1:
表10-22-1
 溶液
溶液试液 |
酸溶液 |
碱溶液 |
|
紫色石蕊试液 |
变红色 |
变蓝色 |
|
无色酚酞试液 |
不变色 |
变红色 |
考点2.浓盐酸、浓硫酸的物理性质及浓硫酸的特性和稀释方法
(1)浓盐酸、浓硫酸的物理性质见表10-22-2。
表10-22-2
|
|
颜色、状态 |
气味 |
挥发性 |
|
浓盐酸 |
无色液体 |
刺激性气味 |
易挥发 |
|
浓硫酸 |
无色黏稠液体 |
无味 |
不挥发 |
(2)浓硫酸的特性:①脱水性:能够夺取纸张、木材、布料、皮肤里的水,使它们脱水生成黑色的炭,发生炭化。②吸水性:浓硫酸跟空气接触,能够吸收空气里的水分,可用作某些气体的干燥剂。③强烈的腐蚀性。④强氧化性,与金属反应时一般不生成氢气。
(3)浓硫酸的稀释:稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中。
考点3.酸的性质及用途
(1)常见的酸:在生活中和实验中常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)等。
(2)盐酸的性质及用途:①化学性质:a.与酸碱指示剂作用;b.与活泼金属发生置换反应;c.与金属氧化物(碱性氧化物)反应;d.与碱发生中和反应;e.与AgNO3发生复分解反应。②用途:重要化工产品,用于金属表面除锈,制造药物等,人体胃液中含有盐酸,可帮助消化。
(3)硫酸的性质及用途:①化学性质:a.与酸碱指示剂作用;b.与活泼金属发生置换反应;c.与金属氧化物(碱性氧化物)反应;d.与碱发生中和反应;e与BaCl2发生复分解反应。②用途:重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属和金属除锈等。
考点4.碱的性质及用途
(1)常见的碱:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
(2)氢氧化钠的性质及用途:①物理性质:氢氧化钠是一种白色固体,极易溶于水,并放出大量的热,容易吸收空气中的水而潮解。②俗名:烧碱、火碱、苛性钠。③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。④用途:化工原料,应用于肥皂、石油、造纸、纺织和印染工业,生活中可用于去油污,固体可用作干燥剂。
(3)氢氧化钙的性质及用途:①物理性质:氢氧化钙是一种白色粉末状固体,微溶于水,水溶液俗称石灰水。②俗名:熟石灰、消石灰。③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。④用途:用于建筑业,制取氢氧化钠,漂白粉,农业上改良酸性土壤,配制农药波尔多液和石硫合剂。
考点3.溶解度与溶质质量分数的关系(拓展考点)
在饱和溶液中:(1) 。
。
(2) 。
。
考点4.化学方程式与溶质质量分数的综合计算(学科内综合考点)
化学方程式表示的是纯净物之间的质量关系,而溶液是混合物,参加化学反应的是溶液中的溶质,所以应求出参加反应的溶质的质量代入化学方程式计算,或求出生成物溶质质量进行计算。
命题主旨往往以混合物(杂质不参加反应,可能作为生成物列入计算溶液的溶质质量分数)与某溶液反应,根据产生的气体(有时运用质量守恒定律确定)或生成的沉淀的质量来确定混合物中该物质的含量,并计算生成物溶液中溶质的质量分数。
注意:在化学反应中溶液的质量=反应前所加各物质的质量总和-反应后生成沉淀的质量-反应后逸出的气体的质量。
第十单元 酸和碱
第22讲 常见的酸和碱
考点1.溶液组成的表示方法
(1)溶液的组成:溶质和溶剂。
(2)浓溶液、稀溶液:在一定量的溶剂里所含的溶质多为浓溶液,所含的溶质少为稀溶液。溶液的“浓、稀”只是溶液组成的一种粗略表示方法。溶液的“浓、稀”与饱和不饱和无关,即浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)用溶质质量分数准确表示溶液的组成;①定义:溶液中溶质的质量分数是指溶质质量与溶液质量之比。②公式: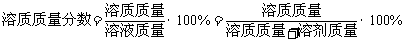
③溶液体积与溶液质量的关系:溶液质量=溶液体积×溶液密度。
考点2.配制一定溶质质量分数的溶液
(1)步骤:①计算:按配制要求计算出所需的溶质和溶剂的量(固体计算出质量,液体计算出体积)。②称量或量取;称量是指称量固体物质的质量,量取是指量取液体物质的体积。③溶解:把溶质和溶剂混合,搅拌至充分溶解即可。
(2)用到的主要仪器:烧杯、量筒、托盘天平、胶头滴管、药匙、玻璃棒等。
考点6.利用溶解度知识配制溶液、分析物质所受浮力改变情况等问题(跨学科渗透考点)
在液体中如果物体所受重力等于浮力,则物体处于悬浮状态。如果浮力小于重力则下沉,浮力大于重力则上浮。由公式 可知,只要我们改变液体的密度,则浮力就会改变,如果液体的密度变小,则浮力变小,物体要下沉;如果液体的密度变大,则浮力变大,物体要上浮。
可知,只要我们改变液体的密度,则浮力就会改变,如果液体的密度变小,则浮力变小,物体要下沉;如果液体的密度变大,则浮力变大,物体要上浮。
第21讲 溶质的质量分数
考点5.晶体及结晶(拓展考点)
(1)晶体:凡是具有规则几何外形的固体叫晶体。如食盐晶体是正六面体(立方体)。
(2)结晶:①定义:在一定条件下,固体物质从它的饱和溶液中以晶体形式析出的过程。②结晶的方法:a.对溶解度受温度变化影响不大的固态溶质,一般用蒸民结晶。b.对溶解度受温度变化影响相当大的固态溶质,一般用冷却热饱和溶液的方法结晶。
考点1.溶液、乳浊液及溶解时的吸热或放热现象
(1)溶液:①定义:一种或几种物质分散到另一种物质中,形成的均一、稳定的混合物。②特征:溶液的特征是均一性和稳定性。
③
溶液质量=溶质质量+溶剂质量
(2)乳浊液:小液滴分散到液体里形成的混合物叫做乳浊液,乳浊液不均一、不稳定,静止后分层。
(3)溶解时的吸热或放热现象
①
②
考点2.饱和溶液与不饱和溶液及其转化
(1)饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液。
 (2)不饱和溶液:在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液。
(2)不饱和溶液:在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液。
(3)饱和溶液与不饱和溶液的转化:对于大多数溶液来说:饱和溶液
不饱和溶液。
(4)判断溶液是否饱和的方法:一定温度下饱和溶液、不饱和溶液的判断方法有两种:①若溶液中有溶质,观察溶质是否减少,如不减少则为此温度下该物质的饱和溶液,反之为不饱和溶液;②若溶液中无溶质,可试着加少量同种溶质观察是否溶解。如溶质不溶解,则为此温度下该物质的饱和溶液,反之为不饱和溶液。
考点3.溶解性、溶解度及溶解度曲线
(1)溶解性:一种物质溶解在另一种物质中的能力叫溶解性,溶解性与溶质和溶剂的性质有关,用易溶、微溶、难溶描述。
(2)溶解度:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫这种物质在这种溶剂里的溶解度。
(3)影响固体物质溶解度大小的因素。内因:溶质、溶剂本身性质:外因:温度,大多数固体物质的溶解度随温度升高而增大;少数固体物质的溶解度随温度变化不大,如NaCl;极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
(4)溶解度曲线:用纵坐标表示物质的溶解度,横坐标表示温度,把物质在不同温度时的溶解度标在图上,画出物质溶解度随温度变化的曲线,这种曲线叫溶解度曲线。
溶解度曲线表示的意义:①同一物质在不同温度进的溶解度数值;②不同物质在同一温度时的溶解度数值;③物质的溶解度受温度变化影响的大小;④比较某一温度下各种物质溶解度的大小。
考点4.气体的溶解度
(1)定义:是指该气体在压强101kPa,一定温度时,溶解在1体积溶剂中达到饱和状态时的气体体积。(2)气体物质溶解度的影响因素,内因:气体和溶剂的性质;外因:温度和压强。气体物质的溶解度随压强增大而增大,随温度的升高而减小。
考点1.金属矿物及铁的冶炼
(1)金属矿物(矿石):①概念:工业上把能用来提炼金属的矿物叫做矿石。②常见的矿石:赤铁矿(Fe2O3)、黄铁矿(FeS2)、菱铁矿(FeCO3)、铝土矿(Al2O3)、黄铜矿(CuFeS2)、辉铜矿(Cu2S)。
 (2)铁的冶炼:①原理:利用高温条件下,焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来。如用赤铁矿石炼铁的化学方程式为:
。②原料:铁矿石、焦炭、石灰石及空气。③设备:高炉。④炼铁时选择铁矿石的标准:a.铁矿石中铁元素的质量分数大(即含铁量高);b.炼铁过程中产物对空气不能造成污染;满足以上两个条件的矿石是理想的绿色矿石。
(2)铁的冶炼:①原理:利用高温条件下,焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来。如用赤铁矿石炼铁的化学方程式为:
。②原料:铁矿石、焦炭、石灰石及空气。③设备:高炉。④炼铁时选择铁矿石的标准:a.铁矿石中铁元素的质量分数大(即含铁量高);b.炼铁过程中产物对空气不能造成污染;满足以上两个条件的矿石是理想的绿色矿石。
考点2.金属的腐蚀和防护
(1)铁生锈的条件:铁生锈的主要条件是与空气和水蒸气直接接触。铁制品锈蚀的过程,实际上是铁与空气中的氧气、水蒸气等发生复杂的化学反应,铁锈的主要成分是Fe2O3·xH2O。
(2)铁的防锈:原理是隔绝空气或水,使铁失去生锈的条件。防锈措施:防止铁制品生锈,一是保持铁制品表面的洁净和干燥,二是在铁制品表面涂上一层保护膜,防止铁与氧气和水的反应,例如:①刷一层油漆;②涂上一层机油;③电镀一层不易生锈的金属,如镀锌等;④经加工使金属表面生成一层致密的氧化膜,如烤蓝;⑤在金属表面覆盖搪瓷、塑料等。
考点3.金属资源的保护
(1)矿物的储量有限,而且不能再生。(2)废旧金属的回收和利用可以减少对环境的污染,还可以节约金属资源。(3)保护金属资源的有效途径:①防止金属腐蚀;②回收利用废旧金属;③合理有效地开采矿物;④寻找金属的替代品。
第九单元 溶 液
第20讲 溶液及分类
考点4.金属的化学性质及其应用(学科内综合考点)
(1)金属的化学性质:①金属与氧气发生化合反应生成金属氧化物;②活泼金属(金属活动性顺序中氢之前的金属)与稀盐酸、稀硫酸发生置换反应生成盐和氢气;③金属与盐溶液发生置换反应生成另一种盐和另一种金属。
(2)金属化学性质的应用:金属与酸的反应、金属与盐溶液的反应,常结合化学方程式的计算、溶液的有关计算来分析溶液质量的变化,天平的平衡、不纯金属中杂质的判断以及溶液中溶质的判断和剩余金属的判断等。
考点5.利用金属与盐溶液的反应解决实际问题(实际应用考点)
随着工农业生产的进一步发展,环境污染越来越严重,造成环境污染的污染源之一就是重金属污染,如铜、汞、铅等重金属。
由金属活动性顺序可知,排在前面的金属能将排在后面的金属从其盐溶液中置换出来,因此向废液中加入一些无毒金属,这样既可解决环境污染问题,又可回收利用金属,提高了经济效益。
第19讲 金属资源的利用和保护
考点1.几种重要的金属及合金
(1)金属的物理特性:常温下除汞(液体)外都是固体,有金属光泽,大多数为电和热的优良导体,有延展性、密度较大、熔点较高。
(2)几种常见金属的比较(见表8-18-1):
表8-18-1
|
金属 |
物理性质 |
用 途 |
|
铁 |
纯铁具有银白色金属光泽、质软,有良好的延展性,密度7.86g/cm3,熔点1535℃,沸点2750℃,是电和热的良导体 |
电器、建筑、工业材料,如:制造桥梁、铁轨、舰船、车辆和各种机械等 |
|
铜 |
紫红色金属,密度8.92g/cm3,熔点1083℃,沸点2595℃,具有良好的延展性、导电性、导热性 |
电线、电缆和各种电器,铜合金可用于制造各种零件等 |
|
铝 |
银白色金属,密度2.70g/cm3,熔点660℃,沸点2467℃,具有良好的延展性、导电性、导热性 |
冶炼金属,做电线、电缆,铝合金用于制造门窗、飞机等 |
(3)合金:①概念:在一种金属中加热熔合其他金属或非金属,而形成的具有金属特性的物质称为合金。②合金的性质能:合金的很多性能与组成它们的纯金属不同,使合金更易适合不同的用途,日常生活中使用的金属材料,大多数为合金。③重要的铁合金:生铁和钢都是铁的合金,其区别是含碳量不同。④生铁的含铁量为2%~4.3%,钢的含碳量为0.03%~2%。
考点2.金属与氧气的反应
大多数金属都能与氧气反应,但反应的难易和剧烈程度不同,越活泼的金属,越容易与氧气发生化学反应,反应越剧烈。
(1)镁、铝与氧气的反应:①在常温下,镁条在空气中发生缓慢氧化而生成白色固体--氧化镁,但在点燃条件下,镁条能在空气中剧烈燃烧,生成白色固钵。②在常温下,铝在空气中发生缓慢氧化,在其表面生成一层致密的氧化物薄膜,从而阻止内部的铝进一步氧化,因此,铝具有较好的抗腐蚀性;在点燃的条件下,铝在氧气中剧烈燃烧生成白色固体--氧化铝(Al2O3)。
(2)铁与氧气的反应:①常温下,铁在干燥的空气中很难与氧气反应;②常温下,铁在潮湿的空气中易生锈;③在点燃的条件下,铁在氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体物质--四氧化三铁。
(3)铜与氧气的反应:①常温下,铜在干燥的空气中几乎不与氧气反应;②铜在空气中加热时,表面会逐渐生成黑色物质--氧化铜;③铜在潮湿的空气中易形成铜绿(碱式碳酸铜)。
(4)金、铂即使在高温下也不与氧气反应。
考点3.金属活动性顺序及置换反应
(1)金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
(2)金属活动性顺序的作用:①判断金属与酸的反应:a. 一般说来,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属不能置换出酸中的氢;b. 酸不包括浓硫酸和硝酸,因为它们有很强的氧化性,与金属反应不能生成氢气,而生成水。②判断金属与盐溶液反应。在金属活动性顺序里,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液中置换出来。③判断金属活动性强弱:在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。④判断金属跟混合盐溶液反应的次序。
(3)置换反应:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。
可用式子表示:A+BC==B+AC;例如:Fe+2HCl==FeCl2+H2↑,Cu+2AgAO3==Cu(NO3)2+2Ag。
考点6.人类能源的新希望--可燃冰(探究性考点)
(1)可燃冰的化学名称为“天然气水合物”。(2)可燃冰是由天然气(主要成分为甲烷)和水在低温、高压的条件下形成的冰状固体,因其极易燃烧,因此称为“可燃冰”。(3)海底不仅蕴藏着大量的煤、石油、天然气等常规化石燃料,而且海底还存有大量的可燃冰。(4)可燃冰燃烧产生的能量比同等条件下的煤或石油产生的能量多得多,而且在燃烧后几乎不产生任何残渣或废气,被科学家誉为“未来能源”“21世纪能源”。
第八单元 金属和金属材料
第18讲 常见金属材料及其化学性质和应用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com