
考点3.某些物质有损人体健康(拓展考点)
(1)生活中的好多物质,如一氧化碳、甲醛、黄曲霉素等对人体的健康有害。
(2)一氧化碳是一种无色无味的气体,易与人体血液中的血红蛋白结合,造成人体组织和器官缺氧。
(3)甲醛能与蛋白质中的氨基反应,使蛋白质分子结构发生变化,失去生理活性而凝固,对人体健康造成危害。
(4)掌握了化学基本知识,知道一些物质对人体健康的影响,可以帮助我们抵御这些有害物质的侵害,保证我们的健康。
考点4.常见毒品及危害(渗透新课标理念考点)
(1)常见的毒品有:鸦片、吗啡、海洛因、冰毒、可卡因、巴比妥类、大麻类等。
(2)毒品的危害:能作用于人的中枢神经系统,具有镇静、止痛和兴奋作用,长期吸毒可使人产生抗药性和对毒品的依赖性,即毒瘾。吸毒对社会、家族、个人都有极大的危害性。
第27讲 常见的化学合成材料
考点1.营养素
(1)营养素包括蛋白质、糖类、油脂、维生素、无机盐和水六大类。
(2)蛋白质:是构成细胞的基本物质,是机体生长及修补受损组织的主要原料。
(3)糖类:是人类食物的重要成分,是由C、H、O三种元素组成的化合物,是生物生命活动中的主要能源。
(4)油脂:油脂的主要功能是供给人体热量,是维持生命活动的重要能源。油脂在人体内完全氧化释放的能量比糖类和蛋白质多。
(5)维生素:维生素是维持生命的要素,使人体得到均衡发展,增强抵抗力,抵御各种疾病。如果缺乏维生素,会引起人体内新陈代谢紊乱,使人处于病态。
考点2.某些元素对人体健康的重要作用
(1)人体由50多种元素组成,其中含量较多的元素有11种,它们约占人体质量的99.95%。
(2)微量元素对人体健康的影响很大,它们能够调节人体的新陈代谢,促进身体健康,而且有些元素是构成人体组织的重要材料。
(3)钙使得骨骼和牙齿具有坚硬的结构支架;钠和钾在人体内主要以离子的形式存在于细胞内液中,起各种调节作用。
(4)对人体补充微量元素的基本观点:①少了会得病,多了同样会得病;②平时注意饮食平衡,不偏食,不挑食;③从食物中仍不能满足摄取量时,可通过食品添加剂和保健药剂来补充。
考点3.农药(拓展考点)
农药是我们眼病、虫、鼠、杂草等进行斗争,保证农业丰收的有效武器,但它本身却是有毒物质,有些对人畜有很大的毒性。有些农药如使用不当,还会对农作物产生药害,或污染水源。因此,施用农药时既要充分发挥农药的药效,又要尽量避免或减少它的药害和毒害。这就需要在施农药前具体了解:农药本身的性质和特点、作物的品种和对药剂的忍受能力、防治对象的生活习性、本地气候条件、合理施用的浓度和方法、安全操作注意事项等。
考点4.化肥的合理施用及施用化肥对环境的影响(学科内综合考点)
化肥的合理施用:肥料的合理施用,要根据土壤的情况和农作物的种类,如碱性土壤中,施用铵态氮肥或普钙(主要成分磷酸二氢钙和硫酸钙)、重钙(主要成分磷酸二氢钙)会损失氮肥或妨碍磷的吸收;硫酸铵、硫酸钾不宜长期大量施用,以免增加土壤的酸性。另外,要注意化学肥料和农家肥料的合理配用,如磷肥(如重钙、普钙)要与农家肥料混合施用,铵态氮肥、磷肥不能与碱性物质如草木灰等混合施用,氨水不能与重钙或普钙混合施用,以免降低肥效。
化肥对提高农作物的产量具有重要作用,但不合理的施用会带来很多环境问题。一方面化肥中常含有一些重金属元素、有毒有机物和放射性物质,进入土壤后形成潜在的土壤污染;另一方面化肥在施用过程中因某些成分的积累、流失或变化,引起土壤酸化、水域氮或磷含量升高,氮的化合物和硫化物气体(N2O、NH3、H2S等)排放等,造成土壤土质退化和水、大气环境的污染。
第十二单元 化学与生活
第26讲 化学物质与健康
考点1.化学肥料的种类和作用
农作物生长需要多种营养元素,其中一部分来自空气、水和土壤,还有一部分靠化学肥料来补充。根据所含植物营养的不同,化肥可分为氮肥、磷肥、钾肥、复合肥料等。不同的化肥对农作物生长的作用是不同的(见表11-25-1)。
|
种类 |
主要作用 |
缺乏时的影响 |
|
氮肥 |
氮是植物体内蛋白质、核酸和叶绿素的组成元素 |
生长迟缓,植株叶片发黄 |
|
磷肥 |
促进作物生长,增强作物的抗寒、抗旱能力 |
缺磷时生长迟缓,产量下降 |
|
钾肥 |
钾具有增强抗病虫害和抗倒伏能力,保证各种代谢过程的顺利进行 |
茎秆细弱,容易倒伏 |
|
复合肥 |
能同时均匀地供给作物几种养分,充分发挥营养元素间的相互作用 |
|
考点2.化肥的鉴别,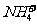 的检验
的检验
不同的氮肥、磷肥、钾肥有不同的性质,根据化肥物理、化学性质不同可初步区分常见的化肥。如:氮肥、钾肥为白色晶体,磷肥为灰白色粉末状;含有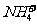 的氮肥加热或加NaOH可产生有刺激性气味的气体NH3。
的氮肥加热或加NaOH可产生有刺激性气味的气体NH3。
考点6.离子的共存(探究性考点)
同一溶液中若离子之间符合下列三个条件之一就会发生离子反应,离子间便不能在溶液中大量共存。①生成沉淀物:如Cl-与Ag+,Ba2+与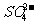 ,OH-与Cu2+、Fe3+,
,OH-与Cu2+、Fe3+,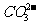 与Ca2+、Ba2+等不能大量共存;②生成气体:如OH-与
与Ca2+、Ba2+等不能大量共存;②生成气体:如OH-与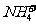 ,H+与
,H+与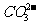 、
、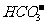 等不能共存;③生成H2O:如H+与OH-不能共存。另外还应注意题中的附加条件,如溶液无色透明,则溶液中肯定没有有色离子(常见的有色离子如Fe3+、Cu2+、Fe2+、
等不能共存;③生成H2O:如H+与OH-不能共存。另外还应注意题中的附加条件,如溶液无色透明,则溶液中肯定没有有色离子(常见的有色离子如Fe3+、Cu2+、Fe2+、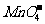 等);pH=1为强酸性溶液;pH=14为强碱性溶液。
等);pH=1为强酸性溶液;pH=14为强碱性溶液。
第25讲 化学肥料
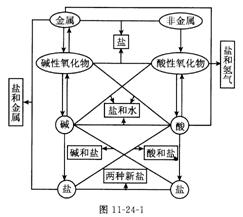
考点5.单质、氧化物、酸、碱、盐的相互关系(学科内综合考点)
单质、氧化物、酸、碱、盐的相互关系可用图11-24-1表示:
考点1.生活中常见的盐
(1)氯化钠(NaCl):①俗名:食盐。②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。③用途:a. 调味品,b. 配制生理盐水,c. 工业原料,d. 工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e. 农业上用氯化钠溶液来选种等。
(2)碳酸钠(Na2CO2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
(3)碳酸氢钠(NaHCO3):俗名:小苏打;用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
(4)碳酸钙(CaCO3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
考点2.盐的化学性质和复分解反应
(1)盐的化学性质:①盐与金属反应生成另一种金属和另一种盐;如Zn+CuSO4==ZnSO4+Cu。②盐和酸反应生成另一种盐和另一种酸;如:BaCl2+H2SO4==BaSO4↓+2HCl。③盐和碱反应生成另一种盐和另一种碱;如:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4。④盐和盐反应生成两种新盐;如:NaCl+AgNO3==AgCl↓+NaNO3。
(3)复分解反应:①定义:两种化合物相互交换成分生成另外两种化合物的反应叫复分解反应。如NaOH+HCl==NaCl+H2O。②发生的条件:酸、碱、盐之间并不是都能发生反应,只有当两种化合物相互交换成分,有沉淀、水或气体生成时,复分解反应才能发生。
考点3.粗盐提纯
粗盐中含有较多的可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等),可以通过过滤的方法把不溶于液体的固体物质跟液体分离。过滤时,液体穿过滤纸上的小孔,而固态物质留在滤纸上,从而使固体和液体分离。粗盐提纯时,把粗盐溶解在水里,经过过滤,把泥沙等杂质从食盐水中除去,然后再通过蒸发结晶,得到食盐晶体。
粗盐提纯中需要的主要仪器有:托盘天平、量筒、铁架台、烧杯、玻璃棒、漏斗、滤纸、酒精灯、蒸发皿。
考点4.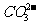 、
、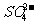 、
、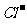 的检验方法
的检验方法
(1)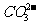 的检验方法:首先将待测样品装入试管中,再加稀盐酸,若观察到产生大量气泡,将产生的气体通入澄清石灰水中,如果澄清石灰水变浑浊,则样品中含有
的检验方法:首先将待测样品装入试管中,再加稀盐酸,若观察到产生大量气泡,将产生的气体通入澄清石灰水中,如果澄清石灰水变浑浊,则样品中含有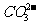 。(2)
。(2)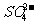 的检验方法:首先将待测样品装入试管中,再加入Ba(NO3)2溶液和稀硝酸,若观察到产生白色沉淀则样品中含有
的检验方法:首先将待测样品装入试管中,再加入Ba(NO3)2溶液和稀硝酸,若观察到产生白色沉淀则样品中含有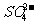 。(3)
。(3)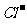 的检验方法:首先将待测样品装入试管中,再加入AgNO3 溶液和稀硝酸,若观察到有白色沉淀产生,则样品中含有
的检验方法:首先将待测样品装入试管中,再加入AgNO3 溶液和稀硝酸,若观察到有白色沉淀产生,则样品中含有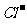 。
。
考点3.通过化学反应前后溶液酸碱性的变化确定溶液pH的变化(拓展考点)
溶液的pH可以发生改变,我们可以通过向溶液中加入酸溶液或者加入碱溶液改变溶液的酸碱性强弱程度。
要使溶液的pH升高,可以向溶液中加入少量的碱溶液;要使溶液的pH降低,可以向溶液中加入少量的酸溶液(或加少量的水)。
考点4.酸碱性对生命活动和农作物生长的影响(实际应用考点)
(1)对生命活动的影响:酸碱性对生命活动有直接地影响。人的胃里含有胃酸,胃酸的主要成分是盐酸,可以帮助消化,但是胃酸中含盐酸过多反而会造成消化不良,在这种情况下可服用含碱性物质[如Al(OH)3、Mg(OH)2等]的药物来中和过多的胃酸。
(2)对农作物生长的影响:酸碱性对农作物的生长有直接地影响。大多数农作物适宜在中性或接近中性的土壤中生长。根据土壤情况,可以利用中和反应,在土壤中加入酸性物质或碱性物质,以调节土壤的酸碱性,使农作物生长良好。
第十一单元 盐 化肥
第24讲 生活中常见的盐
考点1.中和反应及其应用
(1)定义:酸与碱作用生成盐和水的反应,叫中和反应,如NaOH+HCl == NaCl+H2O。
(2)中和反应的实质:酸溶液中的H+与碱溶液中的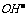 结合生成水的过程,
结合生成水的过程,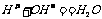 。
。
(3)中和反应与复分解反应的关系:中和反应是复分解反应的一种,复分解反应包括中和反应,即中和反应一定是复分解反应,但复分解反应不一定都是中和反应。
(4)酸碱中和实验要用指示剂:酸与碱反应生成盐和水,如果只从外观上看,无明显现象,由于酸碱指示剂在酸性、碱性和中性溶液中各显示不同的颜色,因此根据颜色变化可判断中和反应的终点。
(5)中和反应的应用:中和反应在日常生活和工农业生产中有广泛的应用,如:改良酸性土壤、处理废水、用于医药等。
考点2.溶液酸碱度的表示方法--pH
 (1)溶液的酸碱度是指溶液的酸性强弱程度。
(1)溶液的酸碱度是指溶液的酸性强弱程度。
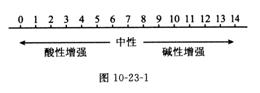
(2)表示方法:用pH来表示,pH的范围通常在0~14之间(如图10-23-1)。PH=7时,溶液呈现中性,pH<7时,溶液呈中性,pH<7时,溶液呈酸性;pH>7时,溶液呈现碱性。
(3)pH的测定方法:测定溶液的酸碱度通常用pH试纸粗略测量。测定方法:①在玻璃片或白瓷板上放一片pH试纸。②用玻璃棒蘸取待测液滴在pH试纸上。③将试纸显示的颜色与标准比色卡比较便知溶液的pH。
考点5.气体的干燥剂(实际应用考点)
浓硫酸、固体烧碱、碱石灰、无水氯化钙可用作气体干燥剂,由于它们的性质不同,被干燥的气体也不同。一般规律见表10-22-3:
表10-22-3
|
干燥剂 |
可干燥的气体 |
不能干燥的气体 |
|
|
酸性 |
浓H2SO4 |
H2、O2、CO、CO2、HCl、CH4、N2、SO2 |
NH3 |
|
中性 |
无水氯化钙 |
除NH3外的其他气体 |
NH3 |
|
碱性 |
固体NaOH、碱石灰、生石灰 |
H2、O2、N2、CO、CH、CH4、NH3 |
CO2、SO2、HCl等 |
第23讲 酸碱之间会发生的反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com