
1.如图,三根绳子上的拉力分别是T1、T2和T3,若悬点B不动,悬点A水平向左移动时,对三根绳子上拉力的变化情况,下列说法正确的是:
A.T1变小,T2、 T3不变; 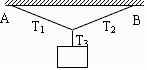
B.T1变大,T2、 T3不变;
C.T1 、T2变大, T3不变;
D.T1 、T2、 T3都变大
26.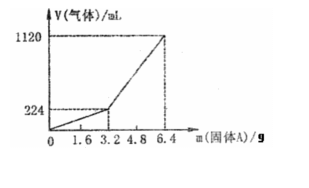 (8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
(8分)将一定量的混合均匀的铁粉和硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解,测得室温下加入的固体A的质量与收集到的气体体积(已换算成标准状况)的关系如图,(假设氢硫酸溶液饱和之前无硫化氢逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢
气,当m>3.2g时收集到的气体为氢气和硫化氢的混合气。
试分析与计算:
(1)3.2g固体A中所含的物质有
(写化学式) 。
(2)3.2g固体A中各物质的物质的量分别为 。
溶于上述盐酸充分反应后,所得的溶液中氢硫酸的物质的量浓度为(忽略体积变化) 。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2g时,收集到的气体体积(标准状况下)V= mL。(用含m的代数式)
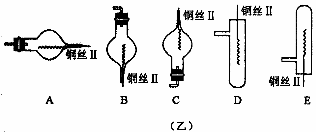
25.(12分)图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状.
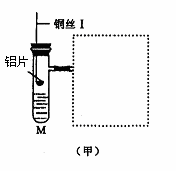
(1)在图甲中,试管M中的液体应选用_____________________________ __.
(2)在图示的虚线框中应连入的最合适的装置是________(填代号)
(3)上述制氢气的方法与将铝片直接加入试管中相比,其优点有_________ _______
______________________________________________________________________.
(4)实验过程中,在试管M中可观察到的现象是________________ _____________
_______________________________________________________________________
___________________________________________________________.
(5)实验时,细铜丝“Ⅱ”的操作方法是________________ ____________________
______________________________________________________________________
__________________________________________.
(6)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体为
________;发生反应的离子方程式为__________________________________.
24.(8分)(2005年广东卷)下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一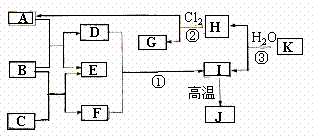 种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:
(1)写出B的化学式_______________,
G的电子式_________________。
(2)反应①的离子方程式为_______________________________________。
(3)反应③的化学方程式为________________________________________。
23.(6分)已知某溶液中只含有4种离子:A+、B-、H+、OH-,对这4种离子浓度的大小比较,有以下3种说法。请判断离子浓度的大小顺序是否正确,你认为正确的请在相应的空格内填上符合这种情况的A+和B-组成物质的化学式(只写一种情况,可以是一种溶质或两种溶质);你认为一定不正确的,请在相应的空格内填上你选择“不正确”的理由。供选择的离子有:Na+、Ag+、NH4+、Cl-、NO3-、CH3COO-、H+、OH-
(1)c(B-)>c(A+)>c(H+)>c(OH-):
(2)c(A+)>c(B-)>c(OH-)>c(H+):
(3)c(H+)>c(B-)>c(A+) >c(OH-):
22.(10分)以石墨做电极电解200mL 0.5mol/L的CuSO4溶液,在标准状况下,阴极上收集到2.24L气体时,停止通电。请回答下列问题:
(1)电解过程中阴极的电极反应式为 、 ;(2分)
(2)电解过程中共收集到气体的体积为 ;
(3)若电解前后溶液的体积变化忽略不计,电解后溶液的pH值约为 ;
(4)电解结束后,欲使溶液恢复到电解前溶液的组成和浓度,可加入 mol ;(2分)
(5)电解时的电流强度为20安培,理论上所需电解时间为 分。(设1mol电子的电量为96500库仑)
21.(6分)下列三组试剂已失去标签,分别用一种试剂可以鉴别。
A、AlCl3、NaCl、Na2CO3三种溶液
B、Na2CO3、Na2SO4、K2S、Na2SO3、BaCl2、NaAlO2六种溶液;
C、CaC2、NaCl、CuSO4、CaCO3、Al2S3五种固体;
A组可选用 (填名称,下同);
B组可选用 ;
C组可选用 。
20.甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧杯中仍有金属剩余,若H2SO4的物质的量浓度为xmol·L-1,则x的范围是
A.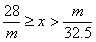 B.
B.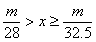
C.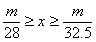 D.
D.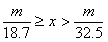
第Ⅱ卷(非选择题,共50分)
19.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌一锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+ H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法正确的是
A.电池工作时,锌为正极
B.电池负极的电极反应式为:2MnO2(s)+ H2O(l)+2e-= Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由负极通过外电路流向正极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
18.下列实验数据记录正确的是
A.用天平称取4.0克NaOH固体,用100ml量筒配制1.0000mol/L的NaOH溶液
B.用25mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液 22.32mL
C.用pH试纸测得新制氯水的pH为4
D.常温下,用气球收集500mlNO2气体,求得NO2气体的物质的量为0.5/22.4mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com