
7.在数列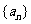 中,若
中,若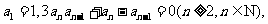 则通项
则通项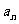 是( )
是( )
A.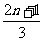 B.
B. C.
C.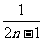 D.
D.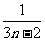
6.将函数y=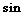 (
(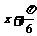 )(
)(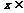 R)的图象上所有的点向左平行移动
R)的图象上所有的点向左平行移动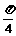 个单位长度,再把图像上各点的横坐标扩大到原来的2倍(纵坐标不变),则所得到的图象的解析式为( )
个单位长度,再把图像上各点的横坐标扩大到原来的2倍(纵坐标不变),则所得到的图象的解析式为( )
A.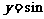 (
(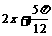 )(
)(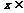 R) B.
R) B.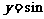 (
(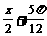 )(
)(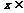 R)
R)
C.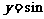 (
(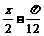 )(
)(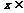 R) D.
R) D.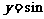 (
( )(
)(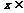 R)
R)
5. 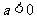 是方程
是方程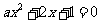 至少有一个负数根的( )
至少有一个负数根的( )
A.必要不充分条件 B.充分不必要条件
C.充分必要条件 D.既不充分也不必要条件
4.已知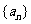 为等差数列,
为等差数列,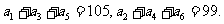
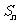 是数列
是数列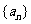 的前n项和,则使得
的前n项和,则使得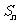 达到最大值的
达到最大值的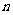 是( )
是( )
A.21 B.20 C.19 D.18
3.
把函数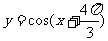 的图象向右平移
的图象向右平移 个单位,所得的图象关于y轴对称,则
个单位,所得的图象关于y轴对称,则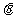 的最小值为 ( )
的最小值为 ( )
(A)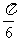 . (B)
. (B) 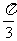 .
(C)
.
(C) 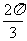 .
(D)
.
(D) 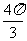 .
.
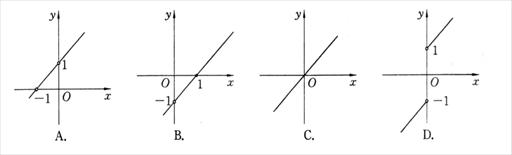
2.函数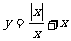 的图象是( )
的图象是( )
1.函数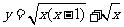 的定义域为( )
的定义域为( )
A.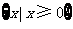 B.
B.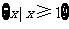 C.
C.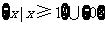 D.
D.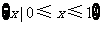
30.计算题:
配制1mol·L-1H2SO4溶液200mL需溶质质量分数为98%(ρ=1.84g·/cm3)的浓H2SO4多少毫升?
29.归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1) 硒的熔点范围可能是___________ (2) 碲的化合价可能有_________________
(3) 硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是_________________(填化学式),
其中H2S的电子式为
(4) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为__________________________________。
(5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
( )A12Te3+( ) 一( )A1(OH)3↓+( )H2Te↑
(6)已知在常温下,H2和S反应生成17g H2S气体放出56.1KJ的热量,
 试写出硫化氢气体分解的热化学方程式:
试写出硫化氢气体分解的热化学方程式:
_______________________ __________
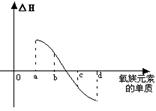
(7) 右图为氧族元素单质与H2反应过程中的能量变化示意图,
其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同
物质的量的单质与H2反应的反应热。则:b代表
________________,d代表_____________(均写单质名称)。
28.⑴ 在右面元素周期表中画出
金属元素与非金属元素的分界线。
⑵ 有人认为形成化合物最多的
元素不是IVA族的碳元素,而是
另一种短周期元素,请你根据学
过的化学知识判断这一元素是
__________。
⑶ 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①写出甲的元素符号 其在元素周期表中对应的位置
② 甲、乙两元素相比较,金属性较强的是_______(填名称), 可以验证该结论的实验是__________。(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com