
8.在K2CO3样品中含Na2CO3、KNO3、Ba(NO3) 2中的一或两种杂质。将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
A.肯定有Na2CO3,没有Ba(NO3)2
B.肯定没有Na2CO3,Ba(NO3)2
C.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
D.无法判断何种为肯定或否定的杂质
第Ⅱ卷(非选择题·60分)
7.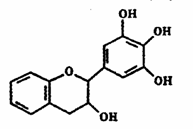 茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如右图所示。关于EGC的下列叙述中不正确的是
茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如右图所示。关于EGC的下列叙述中不正确的是
A.分子中所有的原子共面
B.遇FeCl3溶液发生显色反应
C.1molEGC能与3molNaOH完全反应
D.易发生氧化反应和取代反应,难发生加成反应
6.下列说法正确的是
A.测定HCI和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
B.在101KPa时,l molH2完全燃烧生成液态水,放出285.8 kJ热量,H2燃烧热为
-285.8kJ/mol
C.在101 KPa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热量,则
C的燃烧热为110.5 kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3lKJ/mol,若将含 0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
5.某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S(CuFeS2中S为-2价)。下列说法正确的是
A.反应中,CuFeS2既作氧化剂又作还原剂
B.氧化产物是S,还原产物是Fe2+和Cu2+
C.氧化剂的氧化性Fe3+>Fe2+>Cu2+
D.当转移1mol电子时,有46gCuFeS2参加反应
4.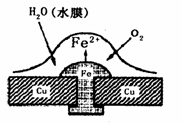 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关
说法中,不正确的是
A.此过程中铜并不被腐蚀
B.此过程中电子从Fe移向Cu
C.正极电极反应式为:2H++2e-=H2↑
D.此过程中还涉及到反应: 4Fe(OH) 2+2H2O+O2=4Fe(OH)3
3.25℃时,浓度为0.2 mol/L的Na2CO3溶液中,下列判断不正确的是
A.加热,c(OH-)增大 B.存在七种粒子
C.存在水解平衡,不存在电离平衡
D.加入NaOH固体,恢复到原温度,c( )增大
)增大
2.Fe3+、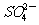 、
、 和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,则X可能是
和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,则X可能是
A.Na+
B.OH-
C. D.Cl-
D.Cl-
1.下列对化学知识的总结,你认为合理的组合是
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④在熔化状态或水溶液中能导电的物质称为电解质
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑥过氧化氢和液氮的分子中都有非极性共价键
A.只有③④ B.只有③⑥ C.只有⑤⑥ D.只有①②⑥
43.(14分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元 素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E是邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素? ,推断依据是 。
(2)根据题目提供的条件,推断E在周期表中的族序数(用必要的文字说明)
。
(3)向甲的水溶液加入MnO2,反应的化学方程式: 。
(4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?(用化学方程式表示) 。
(5)丙是水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(6)向30mL 1mol/LKI溶液中依次注入下列试剂:
①1mL 5mol/L盐酸 ②0.5mol/L 30% 甲溶液 ③1 mL丁。
经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是 。
贵州省乌沙中学09-10学年高三上学期期中考试
42.(8分)有X、Y、Z三种元素,已知:
① X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
② Z与Y可组成化合物ZY3,ZY3溶液遇KSCN溶液呈红色。
请回答:
⑴ Z的基态原子的电子排布式为 。
⑵ 将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 。
⑶ X单质在空气中燃烧生成一种无色有刺激性气味的气体。
① 已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 molO2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 。
② 原无色有刺激性气味的气体与含1.5 molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×10 23个电子转移时,该反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com