
16.在波的传播方向上,距离一定的P与Q点之间只有一个波谷的四种情况,如图A、B、C、D所示。已知这四列波在同一种介质中均向右传播,则质点P能首先达到波谷的是
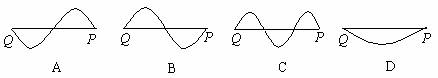
解析:四列波在同一种介质中传播,则波速v应相同。由T=λ/v得:TD>TA=TB>TC;
再结合波动方向和振动方向的关系得:C图中的P点首先达到波谷。正确结论为C
15.如果一弹簧振子做简谐运动,且周期为T,那么以下结论正确的是
A.若t时刻和(t+△t)时刻振子运动速度的大小相等、方向相反,则Δt一定等于T/2的整数倍
D.若t时刻和(t+△t)时刻振子运动位移的大小相等、方向相同,则△t一定等于T的整数倍
C.若△t=T/2,则在t时刻和(t-△t)时刻弹簧的长度一定相等
D.若△t=T,则在t时刻和(t-△t)时刻振子运动的加速度一定相同
解析:若△t=T/2或△t=nT-T/2,(n=1,2,3....),则在t 和(t+△t)两时刻振子必在关于平衡位置对称的两位置(包括平衡位置),这两时刻.振子的位移、回复力、加速度、速度等均大小相等,方向相反.但在这两时刻弹簧的长度并不一定相等(只有当振子在t和(t-△t)两时刻均在平衡位置时,弹簧长度才相等).反过来.若在t和(t-△t),两时刻振子的位移(回复力、加速度)和速度(动量)均大小相等.方向相反,则△t一定等于△t=T/2的奇数倍.即△t=(2n-1)T/2(n=1,2,3…).如果仅仅是振子的速度在t 和(t+△t),两时刻大小相等方向相反,那么不能得出△t=(2n一1)T/2,更不能得出△t=nT/2(n=1,2,3…).根据以上分析.A、C选项均错.
若t和(t+△t)时刻,振子的位移(回复力、加速度)、速度(动量)等均相同,则△t=nT(n=1,2,,3…),但仅仅根据两时刻振子的位移相同,不能得出△t=nT.所以B这项错.若△t=T,在t和(t+△t)两时刻,振子的位移、回复力、加速度、速度等均大小相等方向相同,D选项正确。
14.如图所示,一束光线从折射率为1.5的玻璃内射向空气,在界面上的入射角为45º,下面四个光路图中,正确的是
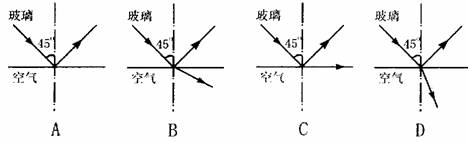
解析:∵玻璃的折射率为n=1.5,∴全反射临界角为c,从图可知入射角a=45º>c,.故发生全反射,即A图正确。
13.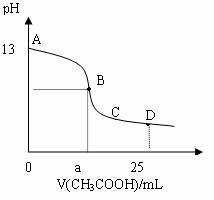 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是
A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO-)
B.C点时,c(CH3COO-)>c(Na+)>c(H+)= c(OH-)
C.D点时,c(CH3COO-)+ c(CH3COOH)==2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO-)>c(OH-) >c(H+)
答案C
解析A不对,因二者刚好反应时,由于生成物水解,溶液呈碱性,故c(Na+)不等于c(CH3COO-);B不对,当c(H+)= c(OH-)时,根据电荷守恒c(Na+)==c(CH3COO-);C正确,根据物料守恒;D不对,初始阶段 c(OH-) > c(CH3COO-)
12.被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005 年底,已被26 个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关该化合物的叙述正确的是
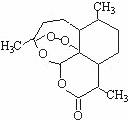
A.分子式为:C 16 H 22 O 5
B.该化合物在一定条件下不能与NaOH 溶液反应
C.该化合物中含有过氧键,一定条件下有氧化性
D.青蒿素与维生素一样是水溶性的
答案C
解析:选项 A 从结构式上可以看出该化合物的分子式是 C 15 H 22 O 5 ;该化合物含有一个酯基,可发生水解,所以可以和NaOH 溶液反应;化合物中含有过氧键,在一定的条件下过氧键能与氢结合成双氧水,具有氧化性;由于分子比较大又有酯基,所以难溶于水。
11.早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔) =4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:
2OH--2e-=H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
答案D
解析:A阳极反应式应为:4OH--42e-=2H2O+O2↑,B钠的还原性比铁强,C前者转移电子数为4,后者为8.
10.下列反应的离子方程式中正确的是
A.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应
CH3OH+H2O-6e-= CO2↑+6H+
B.在NaHSO4溶液中加Ba(OH)2至中性
H++SO42-+Ba2++OH-= BaSO4↓+H2O
C.苯酚钠的水溶液中通入少量的CO2
2C6H5O¯+CO2+H2O→2C6H5OH+CO32-
D.往饱和氯化钠溶液中通入足量氨气和二氧化碳后有NaHCO3晶体析出
Na++NH3+CO2+H2O = NaHCO3↓+NH4+
答案D
解析:选项A是近年来比较关注的燃料电池方面的问题,该原电池通甲醇的一极是负极,发生氧化反应,失去电子,但是电解质溶液是KOH,所以不能生成H+,所以选项A不正确;在NaHSO4溶液中加Ba(OH)2,也就是说NaHSO4是过量的,所以应该是Ba(OH)2按自己的组成完全反应,即H+和OH-的系数都是2,所以选项B不正确;无论CO2的量是多还是少,在苯酚钠的水溶液中通入CO2,产物都是NaHCO3,所以选项C不正确;侯氏制碱中的NaHCO3是沉淀出来的,所以选项D正确
9.下列叙述中完全正确的一组是
①常温常压下,1 mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
A.①②③④⑤ B.②④⑤⑥⑦ C.②④⑤ D.①②⑤
答案C。
解析:甲基是甲烷失去一个H原子后剩余的部分,所以一个甲基中的电子数是9,则
1mol甲基(一CH3)所含的电子数应为9NA;铜锌原电池中正极上生成0.1molH2,需得到0.2mol电子,所以电路中通过的电子也是0.2NA; NO与O2在标况下反应生成NO2,根据反应的化学方程式可以计算出生成的NO2为0.5mol,剩余的O2为0.25mol,即气体的总的物质的量为0.75mol,但NO2还有一个平衡:2NO2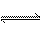 N2O4,而此平衡的存在就使气体的总的分子数小于0.75mol;O3是氧的单质,所以16gO3中所含只有氧原子,氧原子个数为NA;C10H22分子中 C-H 有22个,C- C 9个共31个共价键;氯气只作氧化剂时,1 mol Cl2发生反应,转移的电子为2mol,但在发生歧化反应时,情况就有所不同了,例如,氯气与水反应时,1 mol
Cl2发生反应时,转移的电子为1mol;标准状况下,水呈液态,故22.4L的水并不是1mol。
N2O4,而此平衡的存在就使气体的总的分子数小于0.75mol;O3是氧的单质,所以16gO3中所含只有氧原子,氧原子个数为NA;C10H22分子中 C-H 有22个,C- C 9个共31个共价键;氯气只作氧化剂时,1 mol Cl2发生反应,转移的电子为2mol,但在发生歧化反应时,情况就有所不同了,例如,氯气与水反应时,1 mol
Cl2发生反应时,转移的电子为1mol;标准状况下,水呈液态,故22.4L的水并不是1mol。
8.由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125mL 小分子团水,可维持人体6 小时正常需水量。下列关于小分子团水的说法正确的是
A.水分子的化学性质改变 B.水分子中氢氧键缩短
C.水分子间的作用力减小 D.水分子间结构、物理性质改变
答案:D
解析:小分子团水仍是以分子为基本单位组成的聚集体,所以分子结构并没有改变,分子中的氢氧键并没有缩短,化学性质更不会改变。它改变的是分子间的结构,分子间作用力增强,物理性质改变。 D
7.青海昆仑玉被定为08北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成份为Ca2Mg5Si8O22(OH)2。下列有关说法不正确的是
A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O
B.透闪石的化学式写成硅酸盐的形式为:2CaSiO3·5MgSiO3·H2SiO3
C.透闪石中Mg元素的质量分数是Ca元素质量分数的2倍
D.透闪石中还有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等。
答案:C
解析:从化学式可知,Ca与Mg的物质的量比为2∶5,质量比为2×40∶5×24=80∶120,故质量分数比为2∶3,即Mg元素的质量分数是Ca元素的1.5倍。正确选项为C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com