
4.下列有关人体免疫的叙述.正确的是
A.淋巴细胞能够产生抗体
B.机体自身的组织和细胞也能成为抗原
C.吞噬细胞吞噬外来细菌,必须有抗体参与
D.B细胞和T细胞所含的基因不同,功能也不同
3.酵母菌细胞内代谢过程中具有的特点是
A.氨基酸合成蛋白质时,ADP含量下降
B. 和
和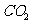 反应产生储存能量的有机物
反应产生储存能量的有机物
C.[H]和氧结合生成水的同时产生大量的能量
D.丙酮酸变成酒精的同时产生[H]、能量、水和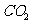
2.下列关于细胞结构和功能的叙述中,不正确的是
A.有核糖体的细胞一定能合成分泌蛋白
B.乳酸菌、酵母茵都含有核糖体、DNA
C.影响线粒体功能的毒素类物质会阻碍根细胞吸收矿质离子
D.根尖分生区细胞和叶肉细胞并不是都有细胞周期,但化学成分却不断更新
1.能够克服种间杂交不亲和性的技术是
A.组织培养 B.细胞融合 C.动物胚胎移植 D.单倍体育种
23.(10分)U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次
增大。已知:
① WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
② Z的单质在X2中燃烧的产物可使品红溶液褪色;
③ V的单质在X2中燃烧可生成VX和VX2两种气体;
④ Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)W与X的氢化物分子结合氢离子的能力较强的是 ,方程式表示 。
(2)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,离子方程式为________
(4)已知右图的球棍模型所表示的是由U、W两种元素组成的共价化合物A,
则A的分子式为 。A与氧气及氢氧化钾溶液还可构成燃料电池,电池正极的电极反应为:

22.(每空4分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物 ,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
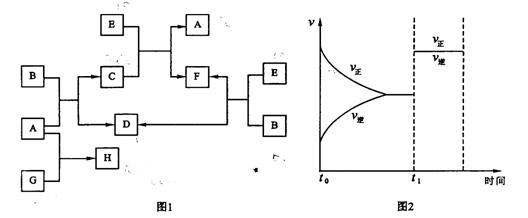
(1)写出A+B→C+D的化学方程式 ;
(2)在101kPa和150℃时,可逆反应E(g)+ B(g) F(g) + D(g)
F(g) + D(g)
反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原
因可能是(填选项字母) ;
A.升高温度 B.增大压强 C.加入催化剂
(3)若G是一种黄色固体单质,16 g G和足量的A反应放出的热量为
QkJ(Q > 0),写出这个反应的热化学 方程式 。
方程式 。
(4)若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式 ;少量H的浓溶液滴入沸水中,继续煮沸,生成了一种红褐色的液体,请用离子方程式表示该过程 。
(5)请写出C与足量的稀盐酸反应的离子方程式__________________
附加题(共10分)
21. (20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
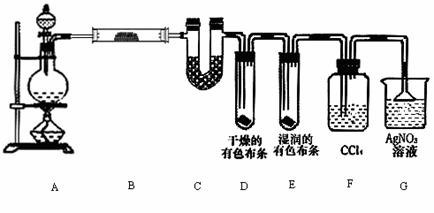
(1)请写出实验室制取氯气的离子方程式: 。
(2)①装置B中盛放的试剂名称及其作用为
,现象是
。
②装置D和E中出现的不同现象说明的问题是 。
③装置F的作用是 。
④写出装置G的作用以及G中倒置的三角漏斗作用是 [来源:学科
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
与 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)。
(4)若用质量分数为36.5%的浓盐酸(密度为1.16 g/cm3)来配制成1 mol/L的稀盐酸 220 mL。应选
mL的容量瓶;经计算需要
220 mL。应选
mL的容量瓶;经计算需要
mL浓盐酸,
若用刚刚洗涤洁净还有水滴的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响” )。
20. 根据下列实验现象,所得结论 正确的是 ( )
正确的是 ( )
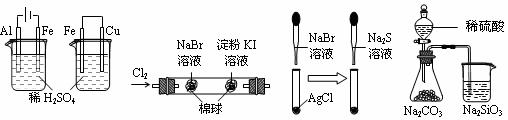
A. B. C. D.
|
实验 |
实验现象 |
结论 |
|
A. |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B. |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C. |
白色固体先变为淡黄色,后变为黑色(Ag2S) |
溶解度:AgCl﹤AgBr﹤Ag2S |
|
D. |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:S>C>Si |
第Ⅱ卷(非选择题,共60分)
19.T℃时,A、B、C三种气体在反应过程中浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确 的是 ( )

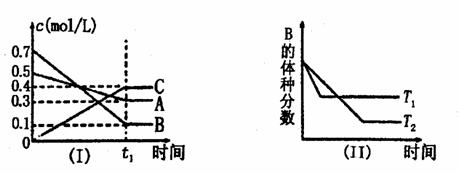
 A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
 B.其他条件不变,升高温度,正、逆反应速率增大,且A的转化率增大
B.其他条件不变,升高温度,正、逆反应速率增大,且A的转化率增大
 C.T℃时,在相同容器中,若
C.T℃时,在相同容器中,若 由0.4 mol/L A、0.4 mol/L B、0.2 mol/L C反应,达到
由0.4 mol/L A、0.4 mol/L B、0.2 mol/L C反应,达到 平衡后,C的浓度也为0.4 mol/L
平衡后,C的浓度也为0.4 mol/L
 D.(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动.
D.(t1+10)min时,保持压强不变,通入稀有气体,平衡不移动.
18.下列说法正确的是 ( )
A.常温下,在pH<7的酸性溶液中,不可能存在NH3·H2O
B.常温下.在pH=7的NH4Cl和NH3·H2O的混合液中。c(NH4+)=(Cl-)
C.将等物质的量的NH4Cl和NH3·H2O溶于水配成溶液.则溶液中c(NH4+)<(Cl-)
D.在0.1moL/L的K2S溶液中:c(K+)=2c(S2-)+c(HS-)+c(H2S)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com