
35.(8分)[生物--现代生物科技专题]
图1表示科学家用植物体细胞杂交技术,将番茄的原生质体和马铃薯的原生质体融合,成功地培育出了番茄一马铃薯杂种植株,但目前还没有实现这个设想--培育出地上结番茄果实、地下结马铃薯块茎的植物。图2表示科学家应用生物工程技术制备单克隆抗体的过程。请据图回答下列问题:
|
|||||||
 |
|||||||
|
|||||||
|
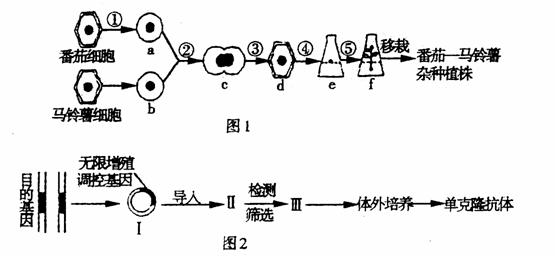
(1)过程②叫做____________技术。与过程③密切相关的具有单层膜的细胞器为____________。
(2)分别用红、绿荧光染料标记a、b细胞膜上的蛋白质,正在融合的原生质体-半发红色荧光,一半发绿色荧光。杂种细胞上a、b两种颜色的荧光均匀分布。这表明细胞膜具有____________性。
(3)若利用此技术生产治疗烫伤、割伤的药物--紫草素,培养将进行到__________(填字母编号)。
(4)“人工种子”与自然种子相比,遗传方面的优点是______________________________
_______________________。
(5)在构建基因表达载体时,无限增殖调控基因的首端应加上控制抗体合成基因的____________。
(6)无限增殖调控基因能激发细胞不断分裂,通过基因工程导入该调控基因来制备单克隆抗体,Ⅱ最可能是_______________细胞,Ⅲ代表的细胞具有_______________的特点。
34.(8分)[生物-生物技术实践]
进度不到暂不考.
33.(8分)[化学-有机化学基础]
 有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl原子取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色
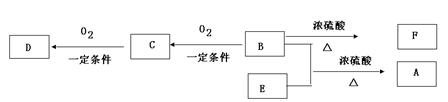
(1)B可以发生的反应有(选填序号) 。(多填扣分)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 、 。
(3)写出C的结构简式: 。
(4)E和B反应生成A的化学方程式 。
32.(8分)[化学-物质结构与性质]
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C同周期相邻,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。C是周期表中电负性最大的元素,E是地壳中含量最多的金属元素。F元素原子最外电子层有两对成对电子,根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的是 (填分子式),它的中心原子的杂化形式是 ,该原子的电子排布式为 。
(2)晶体D2B、D2F的熔点, 更高(填化学式)。
(3)C、D、E可组成离子化合物DxFC6,其晶胞结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是 。指出该物质中微粒间的化学键类型 。
 |
|||||
|
|||||
|
|||||
31. (8分)[化学-化学与技术]以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选) 。
A.CH2=CH2+HCl CH3CH2Cl
CH3CH2Cl
B.CH3 CH2OH+HCl CH3 CH2Cl+ H2O
CH3 CH2Cl+ H2O
C.CH3 CH3+Cl2 CH3 CH2Cl+HCl
CH3 CH2Cl+HCl
D.CH2=CHCl+H2 CH3 CH2Cl
CH3 CH2Cl
由上述四个反应可归纳出,原子经济性高的是 反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化去除。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式 。
(3)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
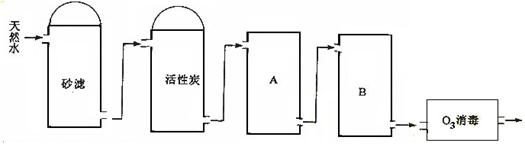
活性炭的作用是 ;B中放置的物质名称是 。
30. (13分)氨气在生活和生产中是一种应用广泛的物质。
(13分)氨气在生活和生产中是一种应用广泛的物质。
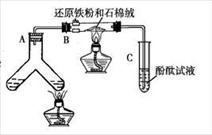
(1)如右图是“合成氨”的演示实验(夹持仪器均已
省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,
另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2, N2
和H2混合后通过还原铁粉来合成NH3,再将产生的气体
通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。
据此回答下列问题:
①Y形管左侧管中发生反应的离子方程式: 。
②铁粉撒在石棉绒上的目的是 。
③有同学认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是 ,请你另设计一个简单的实验验证你的理由 。
(2)2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
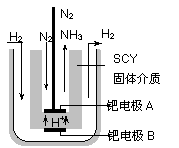
请回答:在电解法合成氨的电解池中 (填“能”或“不能”)用水作电解质溶液的溶剂,原因是 。钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题在答题纸规定的区域作答。
化学部分从以下31、32、33任选一个题作答。若两个均做,按32计分。
29.(14分)Ⅰ.某工厂将含少量氢氧化铁杂质的氢氧化镁提纯的流程如下图所示。
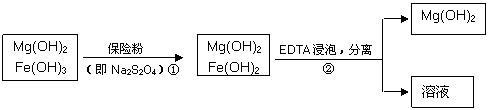
请回答下列问题:
(1)步骤②中分离操作的名称是_____________。
(2)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。
每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是 NA。
(3)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(0H)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释 。
Ⅱ.现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-) ②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在 种粒子。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示 。
28.(15分)水煤气 (主要成分CO、H2 ) 是重要燃料和化工原料。
己知:C (s) + H2O(g)  CO (g)
+H2 (g);△H =+131.3kJ•mol-1
CO (g)
+H2 (g);△H =+131.3kJ•mol-1
C (s) + O2(g)=CO (g); △H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l); △H = -285.8kJ·mo1-1
(1)将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
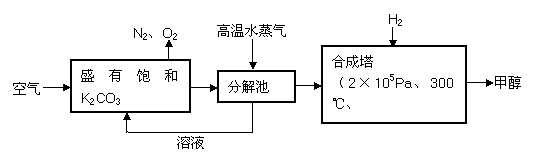 (2)最近科学家基于“绿色自由”构想,把空气的CO2提取出来,经化学反应使之变为可再生燃料甲醇(CH3OH)。技术流程如下:
(2)最近科学家基于“绿色自由”构想,把空气的CO2提取出来,经化学反应使之变为可再生燃料甲醇(CH3OH)。技术流程如下:
请回答下列问题:
①吸收池中K2CO3 吸收CO2反应的化学方程式 。
②向分解池中通高温水蒸气的作用是 。
③在合成塔中,若有4.4kg CO2与足量H2恰好完全反应生成甲醇(CH3OH)和水,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小亮应该选用的试剂是 (从下列提供的试剂中选填序号),实验时测定的数据除空气的体积外,还需要测定 。
吸收可选用的溶液:①NaOH;②Ca(OH) 2;③CaCl 2;④Ba(OH) 2;⑤BaCl 2
27.(16分) 农作物的许多增产措施是通过提高光合作用效率实观的,农业的持续增产增收要以生态系统的稳定性作保证。请分析回答下列问题:
(1)下表是农业科技人员获取的大田农作物叶面积指数(叶面积指数是指单位地表 面积上植物叶片的总面积数量)与细胞呼吸、总光合作用量的相关数据。
|
叶面积指数(cm2/cm2) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
总光合作用量(%) |
12 |
35 |
58 |
76 |
85 |
92 |
93 |
93 |
|
呼吸量(%) |
8 |
25 |
30 |
45 |
50 |
68 |
93 |
97 |
表中数据表明:叶面积指数与农作物有机物积累量之间的关系为_____________________
_________________________________________________________________________________________________。从中我们可以得到的启示是________________________________。
(2)冬季温室栽培农作物,常采用白天调节光照、提升温度和夜间适当降温等措施来增 加产量,其中的道理是___________________________________________________________
______________________________________________________________________________。提升温度的方法很多,你认为采取什么方法,既能充分利用农村现有资源,又经济环保?__________________________________________________________________________。
(3)土壤中的微生物是保证农业生态系统稳定的重要因素,现提供淀粉、土壤浸出液(用取自农田或温室的土壤制成)和其他必要的材料用具,请设计实验方案探究土壤微生物对淀粉的分解作用:
。
26.(17分)“太空甜椒”已进入寻常百姓家,与普通甜椒相比,“太空甜椒”果实大、果皮厚,色泽鲜艳,营养丰富。请分析回答相关问题:
(1)假设普通甜椒的果皮颜色绿色(A)对红色(a)是显性,果皮厚(B)对果皮薄(b)是显性,现把基因型为AaBb个体的花粉传给基因型为aaBb的个体,则该植株所结果实的表现型是____________;子代植株所结果实理论上果皮颜色和果皮厚薄的分离比分别是___________、____________。
(2)甜椒的果实大小是一对相对性状,将选育的大果实太空甜椒在不同地块栽培时,发现有的地里长出的甜椒都是小果实的,这说明生物的性状是____________的结果。
(3)现有纯种小果实普通甜椒和未知基因型的大果实太空甜椒(假设果实大小受基因D、d控制),请设计一个实验方案,以鉴别确定大果实太空甜椒的基因型。写出实验步骤、预测实验结果并得出相应结论______________________________________________________
_______________________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com