
9.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,下表中操作正确的是
|
|
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
 选用滴定管 选用滴定管 |
|
① |
碱 |
酸 |
石蕊 |
(乙) |
|
② |
酸 |
碱 |
酚酞 |
(甲) |
|
③ |
碱 |
酸 |
甲基橙 |
(甲) |
|
④ |
酸 |
碱 |
酚酞 |
(乙) |
A.①② B.①③ C.②③ D.③④
8.以水为溶剂进行中和滴定的原理是:H3O++OH-→2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32- + SO2+ → 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
7.中和滴定实验中,标准NaOH溶液的浓度,通常用H2C2O4·H2O为基准物质进行标定。基准物质必须具备的条件:①物质纯度要高,②相对分子质量较大,③性质稳定,如不易分解、不风化、不潮解、不跟空气中的CO2、O2等反应。实验室标定盐酸的浓度时,选择的基准物质最好是
A.NaOH B.NaHCO3 C.Na2CO3 D.Na2CO3·10H2O
6.用已知浓度的强酸滴定未知浓度的强碱溶液,会导致待测碱液浓度结果偏低的操作是
A.锥形瓶用蒸馏水洗净后装待测液 B.滴定管用蒸馏水洗净后注入标准液
C.滴定前仰视读数,滴定后俯视读数 D.滴定后滴定管尖嘴处悬挂液滴
5.取等体积0.05mol·L-1的Ba(OH)2溶液,分别装入标有①③③④编号的4个锥形瓶中,将①加水稀释到原体积的2倍,在②③中分别通入少量的CO2;④作对照,分别在①②中滴加酚酞做指示剂;在③④中滴加甲基橙做指示剂,用HCl溶液分别摘定上述4种溶液,所消耗HCl溶液的体积(实验允许误差范围内)是
A .②<③=①=④ B .①=②=③=④
C. ①<②<③<④ D. ②<③<①<④
4.两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的移液管取碱液于锥形瓶中。乙则用甲用过的移液管取碱液于刚用水洗过且存在蒸馏水珠的锥形瓶中。其它操作及读数全部正确。你的判断是
A. 甲操作有错误 B. 乙操作有错误
C .甲测定数值一定比乙小 D .乙实际测得值比较准确
3.用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是
A.6.9-7.1 B.3.3-10.7 C.4.3-9.7 D.6-8
2.下列实验操作中所用的仪器合理的是
A.用25 mL的酸式滴定管量取14.80 mL的KMnO4溶液
B.用100 mL的量筒量取5.2 mL盐酸
C.用托盘天平称取25.20 g氯化钠
D.用250mL的容量瓶酸制所需的220mL 0.1mol·L-1的NaOH溶液
1.在一支25ml的酸式滴定管中盛入0.1mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.l mol·L-1NaOH溶液进行中和,则所需NaOH溶液的体积
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5mL
18.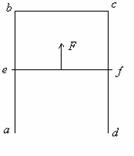 (12分)如图所示,足够长的导线框
(12分)如图所示,足够长的导线框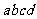 固定在竖直平面内,
固定在竖直平面内,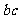 段的电阻为
段的电阻为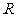 ,其它电阻均可忽略.
,其它电阻均可忽略. 是一电阻可忽略的水平放置的质量均匀分布的直导体杆,杆长为
是一电阻可忽略的水平放置的质量均匀分布的直导体杆,杆长为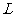 ,质量为
,质量为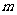 ,杆的两端分别与
,杆的两端分别与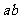 和
和 保持良好接触,又能沿它们无摩擦地滑动。整个装置放在磁感应强度为
保持良好接触,又能沿它们无摩擦地滑动。整个装置放在磁感应强度为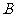 的匀强磁场中,磁场方向与框面垂直.现用一恒力
的匀强磁场中,磁场方向与框面垂直.现用一恒力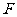 竖直向上拉
竖直向上拉 匀速上升时,其速度的大小为多少?
匀速上升时,其速度的大小为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com